Rua Pelotas, 562
Vila Mariana - São Paulo - SP-
Clínica - CROSP 15302
Responsável Técnico:
Prof. Dr. Francisco Octávio Teixeira Pacca CROSP 49759
TRABALHOS CIENTÍFICOS PUBLICADOS
Clique no ítem abaixo para visualizar a opção desejada.
Adesivo Fibrínico: proposta terapêutica para hemostasia
Carina Cavalcanti
Aluna do 3º ano de odontologia da UNICASTELO
Sâmia Mohamad Saleh
Aluna do 3º ano de odontologia da UNICASTELO
Alessandra Mazzoni
Cirurgiã dentista do Hospital São Paulo (Setor ORL – Hemofilia)
Francisco Octávio Teixeira Pacca
Mestre em Semiologia pela USP; Profº adjunto da UNICASTELO e UNG; Profº titular da UNILUS
Resumo: Os autores fazem uma revisão literária sobre os adesivos fibrínicos atuais, demonstrando suas composições, mecânismos de ação, métodos de aplicação e indicações.
Palavras Chave: Adesivo fibrínico, hemostasia
Introdução: A dificuldade em se obter uma boa hemostasia pode ocorrer durante a prática odontológica, sendo assim importante que o cirurgião dentista tenha conhecimento de alguns recursos terapêuticos disponíveis. Dentre eles, vem se mostrando bastante eficiente os adesivos fibrínicos, pois além de controlar a hemorragia também promovem adesão dos tecidos substituindo o procedimento de sutura, sendo desta maneira muito utilizado em situações emergenciais ou no tratamento de pacientes com distúrbios de coagulação.
Como já sabemos o mecânismo da coagulação tem fundamental importância para obtenção da hemostasia, nele são descritos o que conhecemos como efeito cascata, onde a partir de uma lesão vascular, ocorrem uma série de reações que objetivam a formação de uma rede de fibrina, que é a principal responsável pela manutenção da hemostasia. Este mecanismo pode ser dividido em fases (ROBERT et al.,1991) e será relembrado de forma resumida.
A primeira fase apresenta duas vias no processo de coagulação, chamadas de via intrínseca e via extrínseca.
A via extrínseca é iniciada com lesão do tecido e liberação de tromboplastina tecidual. Nesta via a formação do ativador extrínseco se dá quando o fator III (lipoproteína) é liberado pelos tecidos que estão em torno do vaso sangüíneo, de modo que a função proteica deste fator ativa o fator VII na presença de cálcio e o fator X ativa o fator V que vai agir com a fração lipídica do fator III.
A via intrínseca é iniciada pela exposição do sangue a uma superfície negativamente carregada. Nesta via a formação do ativador intrínseco se dá quando o fator XII se ativa espontâneamente no momento em que entra em contato com as bordas da lesão vascular. Uma vez ativado ele dá origem a uma reação em cascata que consiste na ativação do fator XI na presença do cálcio. O fator XI ativará o fator IX que ativará o fator VIII que ativará o fator X que ativará o fator V. Esse fator V reagirá com fosfolipídeos liberados pelas plaquetas, originando desta forma o ativador intrínseco.
Numa Segunda fase ocorrerá a transformação da protrombina em trombina, transformação esta catalizada pelos ativadores extrínsecos e intrínsecos formados na fase anterior.
Posteriormente, dentro do que ROBERT et al. (1991), chama de terceira fase do processo de hemostasia, a protrombina cataliza a transformação de fibrinogênio em fibrina.
Numa próxima etapa (quarta fase), ocorrerá a polimerização das moléculas de fibrina transformando-as em filamentos que se entrelaçam formando a rede de fibrina, responsável pela retenção do sangue em suas malhas, originando assim o coágulo sangüíneo. Esta fase é catalizada pelo fator XIII e o coágulo formado é uma estrutura frouxa que pode ser deslocado pela própria pressão do sangue .
Na quinta fase ocorre a retração do coágulo, que se caracteriza pela expulsão da água e dos sais minerais, retendo apenas a parte celular e as proteínas plasmáticas, assim o coágulo passa a apresentar uma estrutura mais sólida e resistente.
A última fase (sexta fase) é caracterizada pela fibrinólise, que consiste na reabsorção gradual do coágulo simultaneamente com a cicatrização da parede do vaso sangüíneo, processo este que ocorre 24 a 48 horas após o início da coagulação, de forma que a substância responsável pela reabsorção do coágulo é a fibrinolisina, substância esta ativada pelo fator XIII.
Através dos tempos, algumas manobras e/ou recursos terapêuticos vem sendo discutidos na literatura médica e odontológica, com o objetivo de atingir uma boa hemostasia. Estes artifícios são muito importantes, principalmente quando intervirmos em pacientes hemofílicos ou com distúrbios de coagulação.
Dentro do nosso estudo nos propusemos a efetuar uma revisão de literatura sobre os adesivos fibrínicos, focalizando suas composições, mecânismos de ação, aplicação e indicações.
Revisão da literatura:
Composição e mecânismo de ação do adesivo fibrínico
Os adesivos fibrínicos, em sua grande maioria, se baseiam na mistura de dois componentes, onde o primeiro representa um concentrado de fibrinogênio, fator XIII e fibronectina, e o segundo representa um concentrado de trombina obtidos do plasma humano.
O fibrinogênio após transformado em fibrina, forma uma rede de sustentação para o coágulo. Assim, alguns estudos comprovaram que quanto maior a concentração de fibrinogênio ( até 120mg/ml), maior é a resistência à tração do coágulo que será formado.
O fator XIII obtido do plasma humano é uma pró-enzima que consiste de duas cadeias A e duas B. Este fator é ativado pela trombina através da cadeia A formando o fator XIIIa na presença de íons de cálcio, sendo que este fator, é um catalizador da formação de ligações cruzadas entre as moléculas de fibrina, proporcionando à formação de um coágulo de fibrina estável e insolúvel (HERMANS & MACDONAGH, 1982). O fator XIIIa também protege o coágulo contra uma possível degradação prematura pela plasmina, pois ele atua como um catalizador do inibidor da plasmina (TAMAKAI & AOKI, 1982). O fator XIII também mostrou-se capaz na estimulação da proliferação de fibroblastos (BECK et al., 1961),melhorando a reparação tecidual.
A fibronectina pode contribuir para a fixação do coágulo no local da lesão quando faz a ligação cruzada com a fibrina (BOCKENSTEDT et al., 1986; MOSHER, 1984).
A trombina humana é uma enzima que converte o fibrinogênio em fibrina, sendo gerada na sua forma inativa, além de ser responsável pela ativação do fator XIII na presença de íons de cálcio.
Os componentes do fibrinogênio e trombina, antes do uso, são liofilizados (secagem e eliminação de substâncias voláteis, realizados sob baixa temperatura e pressão reduzida) e solubilizados com soluções de aprotinina e cloreto de cálcio, respectivamente.
A aprotinina é obtida do tecido pulmonar bovino e é um inibidor de proteases. Possui um efeito antifibrinolítico porque inibe fortemente a plasmina. Assim, podemos dizer que a aprotinina tem como função impedir a fibrinólise excessivamente rápida do coágulo de fibrina pela plasmina endógena.
O cloreto de cálcio é um componente inorgânico composto por íons de cálcio necessários para a ativação do fator XIII e para a manutenção de sua forma ativa. Tais íons influenciam na estabilização da fibrina através de ligações cruzadas.
A mistura dos dois componentes é feita na presença de íons de cálcio, reproduzindo a última fase da cascata da coagulação e levando à polimerização gradual da principal proteína estrutural do sangue (fibrinogênio), ocorrendo à formação de coágulos de fibrina insolúveis, quando estão em união com as plaquetas.
Com relação ao agente antifibrinolítico (aprotinina), a quantidade total utilizada no adesivo é menor quando comparada com a quantidade total administrada à pacientes hemofílicos (MARTINOWITZ & SCHULMAN, 1995). A aplicação experimental de adesivo fibrínico na ausência de um agente antifibrinolítico pode diminuir a resistência do coágulo, principalmente em casos onde a atividade proteolítica é elevada.
No que diz respeito à protease coagulante (trombina), os adesivos fibrínicos produzidos nos EUA são em sua maioria, produzidos com trombina derivada de plasma humano, para evitar problemas imunológicos encontrados no plasma bovino.
A fibrina é capaz de interagir com tecidos através de ligações covalentes (SIERRA, 1993) com a fibronectina, às plaquetas e aos fibroblastos fixando assim o coágulo ao colágeno. A fibrina vai sendo degradada através da atividade proteolítica do coágulo e os produtos de sua degradação estimulam a migração de monócitos que se convertem em macrófagos para remover a fibrina degradada por fagocitose. Os fibroblastos estimulados que migram para dentro da rede de fibrina depositam colágeno e separam os ativadores de plasminogênio que contribuem para a lise da fibrina, favorecendo a neovascularização.
| Componentes | Concentração | Origem |
| Fibrinogênio(coagulável) | 80-120 g/l | Plasma humano |
| Fator XIII (atividade) | 10-30 UI/ml | Plasma humano ou placenta humana |
| Fibronectina (antígeno) | 5-20 g/l | Plasma humano |
| Trombina (atividade) | 300-600 UI/ml | Plasma humano ou Plasma bovino |
| Aprotinina | 3.000 UIK/ml | Pulmão bovino |
| Cloreto de cálcio | 40-60 mM | Inorgânico |
(Figura 3.) Componentes usuais dos adesivos fibrínicos comerciais
* UI: Unidade Internacional / UIK: Unidade de Inativador de Calidinogenase / mM: Milimol
Métodos de produção
A produção comercial pode ser feita a partir de crioprecipitado de plasma, que são fontes de fibrinogênio. A primeira fonte é obtida pelo descongelamento de plasma, produzindo assim uma pasta recuperada na centrifugação. O crioprecipitado contém fibrinogênio, fibronectina, fator XIII e outros componentes do plasma que são sedimentados (depositados sobre uma superfície aquosa) durante a fase de centrifugação. A segunda fonte é obtida a partir de plasma humano integral precipitado à baixa temperatura (-3 a –5ºC).
A produção compreende, em geral, diversas fases de precipitação para aumentar a pureza do fibrinogênio pela diminuição da proporção relativa de fibronectina. As fases de purificação devem ser programadas de maneira que não altere a coagulabilidade do fibrinogênio (RADOSEVICH et al., 1997).
A variação no modo de precipitação e de purificação influencia na composição do produto final, o mesmo acontece com o tipo de tratamento de inativação de vírus. Isso afeta a recuperação e o comportamento biológico dos componentes do plasma (RADOSEVICH et al., 1997).
Aplicações clínicas do adesivo fibrínico
Os primeiros resultados clínicos do uso do adesivo utilizando trombina bovina foram observados em paciente submetidos à cirúrgias oftálmicas e tais resultados foram excelentes. Mas somente após muitos anos, o produto começou a ser comercializado porque já possuía uma maior segurança viral.
Para todos os tipos de cirurgias a hemostasia rápida e eficiente é de extrema importância. Assim sendo, o adesivo fibrínico tem sido um bom indicador para hemostasia local e para prevenção de hemorragia recorrente em praticamente todas as indicações cirúrgicas.
BERG et al. (1991) e MORAWITZ et al. (1995), avaliaram as recidivas de sangramento em pacientes hemofílicos submetidos a pequenas cirurgias e constataram que com a utilização do adesivo fibrínico diminuiu em aproximadamente quatro vezes as hemorragias tardias, quando comparados a pacientes operados sem o adesivo.
Em se tratando de hemostasia em cirúrgias dentárias, um estudo foi feito com 59 pacientes portadores de distúrbios de coagulação, onde a recidiva de sangramento foi de 3% (2 pacientes), demonstrando assim que com a alta potência hemostática do adesivo, obteve-se novas opções de tratamento cirúrgico em pacientes de alto risco, sem substituição excessiva dos fatores de coagulação ou suspensão da terapia anticoagulante (MARTINOWITZ et al., 1990). Uma outra área que comprovou a eficácia do adesivo foi na selagem de cavidades corporais, como na cirurgia torácica para fechamento do esterno, anastomose da traquéia e, particularmente, na selagem de lesões pulmonares (GUST et al.,1990; KOIKE et al.), onde podem levar a infecções em 2 a 3 % dos pacientes (WILLIANS & LEWIS, 1976).
Em se tratando de reações adversas, elas são discretas, caracterizando-se por eventuais febres, calafrios e pequenas reações alérgicas e são observadas em apenas 1% dos casos. (MARTINOWITZ & SCHULMAN, 1995).
Medidas utilizadas para reduzir o risco de transmissão viral
Os principais componentes do adesivo fibrínico (fibrinogênio, fator XIII e trombina) são isolados do plasma humano. Assim, é muito importante a tomada de medidas efetivas para prevenir e reduzir as possíveis contaminações. Tais medidas devem ser tomadas durante a produção do adesivo, a mais importantes são aquelas para reduzir o risco de transmissão viral através do controle do plasma doado e dos doadores de plasma, onde os doadores são selecionados e o plasma doado é monitorado de acordo com a Organização Mundial da Saúde (OMS). Cada doador é testado para os antígenos de superfície da hepatite B (HbsAg), anticorpos contra vírus da imuno deficiência humana um e dois (HIV-1 e 2) e vírus da hepatite C (HCV), onde serão utilizados somente plasma de doadores sadios que forem negativos. Todo o plasma é submetido a um período de quarentena (quarenta dias) e é liberado somente após a segunda doação da pessoa. Com relação a inativação e eliminação de vírus humanos como HIV-1 e 2, vírus da hepatite B (HBV), HCV, vírus da herpes (HSV) e poliovírus, todos os processos inativam e eliminam vírus patogênicos ao homem resultando em uma altíssima margem de segurança do produto, praticamente eliminando os riscos de transmissão de doenças infecciosas virais (RADOSEVICH et al., 1997).
Os métodos de inativação de vírus atualmente empregados para os componentes de plasma humanos dos adesivos fibrínicos comerciais são: aquecimento por vapor e pasteurização. Tais métodos foram avaliados em experiências clínicas e foram considerados capazes de assegurar uma margem de segurança suficiente contra os principais vírus transmitidos pelo plasma humano (HIV, HBV e HCV). Ainda estão em desenvolvimento os métodos por calor seco e irradiação por ultra violeta C (UVC).(RADOSEVICH et al., 1997)
Adesivos fibrínicos Autólogos
Existe também o adesivo fibrínico autólogo e o crioprecipitado alogênico que são obtidos através de uma única unidade de plasma (ALVING et al., 1995). O adesivo autólogo apresenta como principal vantagem e indicação a não contaminação viral e/ou bacteriana, visto que em plasmas homólogos não ocorre a formação de “pools”, mas não pode-se afirmar e garantir uma situação de risco zero, pois esta contaminação pode se dar pelo operador e/ou equipamentos no momento do processamento do adesivo, a menos que este procedimento seja realizado em um mecanismo fechado e estéril. Apresentando como desvantagens a baixa propriedade reológica (elasticidade e resistência a tensão) devido a pequena quantidade de fibrinogênio, que quando misturado com a trombina resultará em um coágulo de fibrina com pouca resistência (REISS, 1996). Em casos de emergências cirúrgicas, este adesivo não é indicado por exigir um certo tempo para sua produção.
Métodos de aplicação
A aplicação do adesivo fibrínico pode ser realizada através de duas técnicas diferentes, a técnica seqüencial e a técnica simultânea. (REDL et al., 1973)
A técnica seqüencial consiste na utilização de duas seringas auxiliadas por cânulas, spray ou catéteres, estes desenvolvidos para aplicação endoscópica, neste caso deve-se primeiramente lavar o catéter com solução salina, fazer a aplicação do fibrinogênio, lavar novamente com solução salina, realizar a aplicação de trombina e finalmente lavar com solução salina.
A técnica simultânea é realizada através de um dispositivo que permite a aplicação simultânea, sendo composta por uma peça em forma de Y que é fixada nas extremidades das seringas e uma cânula ou catéter, sendo selecionado o mais apropriado de acordo com o procedimento cirúrgico em questão. Primeiramente deve lavar os catéteres com solução salina, realizar a aplicação simultânea dos componentes do adesivo fibrínico (fibrinogênio e trombina) e por último nova lavagem com solução salina.
A utilização de duas seringas é indicada para aplicação do adesivo fibrínico em pequenas superfícies do corpo. A técnica de vaporização ou spray é indicada em situações de hemorragia difusa ou grandes áreas por ser aplicada sob a superfície em forma de aerossol, assegurando uma cobertura homogênea do tecido a distância considerada ideal para a aplicação varia de dez a vinte cm.
Indicações do adesivo fibrínico
O tampão com base de fibrina é utilizado em alguns países Europeus, sendo composto por camadas liofolizadas de colágeno, fibrinogênio, fibrina e aprotinina. Ele é utilizado em procedimentos cirúrgicos de órgãos moles que apresentam uma eficácia melhor em relação a sutura e cauterização. Atualmente existem novos métodos que combinam fibrinogênio, plaquetas e trombina (KEVY et al.,1996) ou fibrinogênio, elastina e trombina (RIQUET et al., 1990).
Pelo fato do adesivo apresentar consideráveis propriedades na coaptação de tecidos, como agente hemostático entre outras, este passou a ter disponibilidade para usos clínicos em variadas indicações, de modo que as aplicações mais comuns do adesivo é no campo cirúrgico e em pacientes portadores de coagulopatias.
Em traumatologia o uso do adesivo é de grande valia e eficácia, pois em casos de acidentes a fraturas compreende tanto estruturas moles quanto duras, resultando em quadros hemorrágicos muito intensos dificultando ou até mesmo impossibilitando o uso de suturas com recurso de intervenção. Ensaios experimentais demonstram que com o uso do adesivo de fibrina em cirurgia de tecidos moles obteve-se com resultado uma rápida cicatrização e melhor estética, com ausência de complicações (EGKHER et al., 1986), pois nos casos de tratamento de pele o adesivo de fibrina é considerado o tratamento ideal por promover a regeneração a partir de tecidos circunvizinhos, substituindo desta maneira o tratamento através de suturas. O adesivo de fibrina também é o mais indicado em situações de lesões ósseas das articulações, pois promove uma eficácia considerável no processo de osteossíntese.
Nas cirurgias odontológicas convencionais o adesivo pode ser utilizado para o preenchimentos de cavidades nas extrações dentárias, em pacientes com tendência ao sangramento ou que estejam administrando algum tipo de anticoagulante., com o objetivo de proporcionar uma hemostasia local.
O adesivo fibrínico também pode ser utilizado associado a administração de drogas como meio de controle de liberação em regiões selecionadas como alvo, principalmente os agentes quimioterápicos e os antibióticos, ou junto a hormônios associados com os fatores de cicatrização. (RADOSEVICH et al.,1997).
Conclusão: O adesivo fibrínico demonstrou ser, muito útil em diversas aplicações nos diversos campos cirúrgicos para controle de hemorragias, coaptação e fechamento de feridas e principalmente na manipulação de pacientes hemofílicos ou com distúrbios de coagulação. Em virtude da flexibilidade de seu uso e, mais recentemente da diversidade de dispositivos para a sua aplicação, esse derivado do plasma humano vem se tornando essencial, prático e eficaz na cirurgia em diversas situações clínicas. O adesivo fibrínico é um produto biológico e biodegradável que, em contraste com adesivos sintéticos, não causam reações adversas ao tecido. A extensão de segurança contra vírus destes adesivos derivados de plasma alcançaram níveis satisfatórios após a introdução de tratamentos eficientes de inativação viral.
Referências Bibliográficas: ALVING, B.M., WEINSTEIN, M.J., FINLAYSON, J.S., MENITOVE, J.E., FRATANTONI, J.C.// Fibrin sealant: summary of a conference on characteristics and clinical uses.// Transfusion, 1995.// p.783-790., v.35.
BECK, E., DUCKERT, F., ERNST, M.// The influence of fibring stabilizing factor on the growth of fibroblasts in vitro and wound healing.// Thromb Diath Haemorrh, 1961.// p.485-491., v.6.
BERG, P., BARINA, W., BORN, P., SIMON, W., ZELLMER, R., PAUL, R.// Fibrinkleber versus polidocanol beider olveren gastrointestinalblutung: fibrin selant vs. Polidocanol in upper gastrointestinal bleeding.// Henning H, Soehendra N; Fortskoíe, 1991.// p.22-24., v.XX.
BOCKENSTEDT, P., MACDONAGH, J., HANDIN, R.T.// Binding and covalent cross-linking of purified von Willebrand factor to native monomeric colagen.// J. Clin Invest, 1986.// p.551-556., v.78.
DVORA, H.F., HARVEY, V.S., ESTRELLA, P., BROWN, L.F., MCDONAGH, J., DVORAK, A . M.A. // Fibrin containing gels induce angiogenesis: im aplications for tumor stroma generation and wound healing.// Vox Sang, 1987.// p.673-686., v.57.
EGKHER, E., SPÄNGLER, H., SPÄNGLER, H.P.// Indications and limits of fibrin adhesive applied to traumatological patients: fibrin sealant in operative medicine.// Springer, 1986.// p.144-153., v.7.
GUST R., KLEINE P.,FABEL H.// Tetracylinplerodese bei rezidivierenden malignen Pleuraergüssen. Eine randomisierte Vergleichsunter-sunchung: pleurodesis by fibrin sealant and tetracyclin in recurrent malignant pleural effusions.// Med Klin, 1990.// p.18-23., v.85.
HERMANS, J., MACDONAGH, J.// Fibrin: structure and interactions.// Semin Thromb Hemost, 1982.// p.11-24., v.8.
KEVY, S.V., JACOBSON, M.S., BLASETTI, L.// An automated device for the rapid preparation of autologous fibrin.// La Jolla, 1996.
KOIKE T., HIRONO, T., EGUCHI, S., NAGASHIMA, A., FURUKAWA, T., YASUMOTO, K., SUGIMACHI, K., NIIZUMA, M., KAWAMURA, I., HAIATA, Y., YAIITA, H., HIROTA, N., SAKAMOTO, R., SUZUKI, K., NAGASHIMA, Y., MORIYAMA, R.// Sealing of Air Leakage in Lung Surgery by Fibrin Adhesive.// Manuscript of study results, 1985.
KRAM, H.B., NATHAN, R.C., MACKABEE, J.R., KLEIN, S.R., SHEEMAKER, W.C.// Clinical use of nonautologous fibrin glue.// Am Surg, 1998.// p.570-573., v.54.
MARTINOWITZ, U., SCHULMAN, S.// Fibrin sealant in surgery of patients with a hemorrhagic diathesis.// Thromb Haemost, 1995.// p.486-492., v.74.
MARTINOWITZ, U., MAZAR, A.L., TAICHER, S., VARON, D., GITOL, S.N., RAMOT, B., RAKOCZ, M.// Dental extractions for patients on oral anticoagulant therapy in: oral medicine and oral pathology.// Mosby Year Book, Inc., 1990.// p.247-277., v.70.
MATRAS, H.// Fibrin seal: the state of the art and oral maxilofac.// Surg, 1985.// p.605-611., v.43.
MORAWITZ, P.// Die chemie der blutgerinnung: chomistry of coagulation.// Erg. Physiol., 1995.// p.307-422., v.4.
MOSHER, D.P.// Cross-linking of fibronectin to colagenous proteins.// Mol Cell Biochem,1984.// p.63-68., v.58.
MOURITZEN, C., DRÖMER, M., KEINECKE, H.O.// The effect of fibrin glueing to seal bronchial and alveolar leakages after pulmonary resections and decortications.// Eur J. Cardio-thorac Surg, 1993.// p.75-80., v.7.
RADOSEVICH, M., GOUBRAN, H. A., BURNOUF, T.// Fibrin selant: cientific rationale, production methods, properties, and current clinical use.// Vox Sanguinis, 1997.// p.133-143., v. 72.
REDL, H., SCHLAG, G., DINGES, H.P.// Methods of fibrin seal application.// Torac Cardiovasc Surg, 1973.// p.223-227., v.30.
REISS, R.F.// Autologous fibrin glue: production and clinical use.// Transfus Med Rev., 1996.// p.85-92., v.2.
RIQUET, M., CARNOT, F., GALLIX, P., CALLISE, D., LEFEBRE, F., RABAUD, M.// Biocompatibility of elastin-fibrin material in the rat.// Biomaterials, 1990.// p.518-520., v.11.
ROBERT M. BERNE, M.D., MATTHEW N. LEVY, M.D.,CHARLES ALFRED ESBÉRARD.// Princípios de fisiologia.//Guanabara Koogan,1991.// p.165-169.
SIERRA, D.H.// Fibrin sealant adhesive systems: a review of their chemistry, material properties and clinical applications.// J. Biomater Appl., 1993.// p.309-352., v.7.
TAMAKAI T., AOKI N.// Crosslinking of a 2-plasmin inhibitor to fibrin catalized by activated fibrinstabilizing factor.// J Biol Chem 1982.// p. 14767-14772., v. 257.
WILLIANS, N.S., LEWIS, C.T.// Bronchopleural fistula: a review of 86 cases.// Br J. Surg, 1976.// p.520-522., v.63.
Aferição de halitose através da concentração de compostos sulfurados voláteis após métodos de higienização lingual químico e mecânico
MÉTODOS DE HIGIENIZAÇÃO LINGUAL QUÍMICO E MECÂNICO
* ARTUR CERRI
** CARLOS EDUARDO XAVIER DOS SANTOS RIBEIRO-DA-SILVA
*** FRANCISCO OCTÁVIO TEIXEIRA PACCA
**** LUIZ FERNANDO RODRIGUES INNOCÊNCIO
Parte da Pesquisa desenvolvida na Faculdade de Odontologia da UNIVERSIDADE GUARULHOS (SP)-UnG, pelo grupo de pesquisa Estomatologia sob o patrocínio do CEPPE (Centro de Pós Graduação e Pesquisa)
RESUMO
A halitose ou mau hálito além de ser considerada uma doença e por isso merecer tratamento, é um fator limitante no contato social já que as pessoas possuidoras dessa condição, acabam muitas vezes sendo privadas do convívio social, dificultando inclusive as relações profissionais e conjugais.
As causas da halitose estão relacionadas a inúmeros fatores, quer de ordem local, quer de ordem geral, destacando-se principalmente as causas locais ( cavidade bucal ) e dentre estas, a língua saburrosa é considerada a principal fonte do mau hálito. No presente trabalho são discutidos os métodos mecânicos e químicos no combate a halitose, realizado em 200 pacientes adultos, de ambos os sexos, oriundos da Clínica Odontológica da Universidade Guarulhos – UnG.
Para confirmar o diagnóstico de halitose, os autores utilizaram o aparelho Halimeter, de alta precisão que detecta a presença de compostos sulfurados voláteis ( CSV ) existentes na boca.
__________________________________________________________________
* Especialista, Mestre e Doutor em Estomatologia
Professor Titular de Estomatologia da Universidade Guarulhos
** Especialista e Mestre em Estomatologia
Doutorando pela UNIFESP/EPM
Professor de Estomatologia da Universidade Guarulhos
*** Especialista e Mestre em Estomatologia
Doutorando pela USP
Professor de Estomatologia da Universidade Guarulhos
**** Especialista e Mestre em Estomatologia
Professor de Estomatologia da UnG
PALAVRAS-CHAVE
Halitose – Odor bucal – Língua saburrosa
INTRODUÇÃO
A palavra halitose é derivada do latim, “feto oris”, e significa mau hálito, sendo designada para o odor fétido de origem bucal. ( CERRI,2000 )
Titus Március Plátus (254-184 a.C.), dramaturgo romano, classificou o “fedor da boca” entre as muitas razões de infidelidade conjugal (TOMMASI, 1989).
Pierre Fauchard (1678-1761), receitava bochechos com a própria urina do paciente, alegando ser essa a melhor solução contra a halitose. São inúmeros os exemplos na História de receitas e superstições utilizadas na tentativa de se acabar com a halitose. Dentre estas possibilidades, muitas eram plantas e ervas com gosto e cheiro agradável.
Por isso, muitos dos colutórios, cremes dentais e chicletes contém na sua composição herbáceos como por exemplo a menta, malva, hortelã, eucalipto entre outros.
O crescente aumento na produção e comercialização de produtos cujo objetivo seja minimizar os efeitos maléficos da halitose denota a preocupação da população com este problema.
Existem inúmeras causas possíveis da halitose, sendo estas divididas didaticamente em causas locais ( cavidade bucal ) e causas de ordem geral ( sistêmica ). As causas locais são responsáveis por 90% dos casos de halitose tendo como exemplo os processos cariosos, a placa bacteriana, próteses mal adaptadas, gengivites, periodontopatias, língua saburrosa, língua fissurada, alteração na composição da saliva e as doenças próprias da boca. ( CERRI & MARTI, 2000 )
Dentre as causas locais, a de maior importância como fonte de halitose, é sem sombra de dúvida a língua saburrosa, ou seja, crescimento excessivo das papilas filiformes do dorso da língua e que causam retenção alimentar. ( BOEVER,1995 )
As causas gerais implicam numa variedade muito extensa, podendo ser originárias do sistema respiratório como as sinusites e amidalites ( particularmente a amidalite caseosa) respondendo por 8% dos casos de halitose; De origem digestiva destacam-se a eructação gástrica, dispepsia, e o refluxo gastro-esofágico; De origem metabólica e sistêmica podemos citar a diabetes, uremia, enfermidades febris, alterações hormonais, xerostomia e até mesmo o estresse.
O diabetes mellitus impõe aos pacientes um hálito característico denominado hálito cetônico, graças a evaporação de corpos cetônicos.
Existem ainda outras causas como alho, cebola e condimentos além das situações de jejum prolongado, e determinados tipos de dieta alimentar que provocam a halitose temporária e portanto não patológica. (BOELTER, 1999; CARLSON-MANN, 1998; PENTEADO, 1999 )
Numa pesquisa realizada pelo Centro de Halitose da Califórnia, cerca de 60% da população americana é portadora de halitose crônica e aproximadamente 100% é portadora de halitose matutina (KOLBE, 1999).
A língua saburrosa, alteração relativamente comum, é formada basicamente por restos alimentares, células descamadas, fungos, bactérias e enzimas ativas que participam do processo de digestão.
Existem mais de 450 microrganismos que habitam a cavidade bucal e ainda não foi possível determinar exatamente quais destes são os responsáveis pela degradação de substrato protéico cujo produto metabólico são os compostos sulfurados voláteis ( CSV ), os ácidos graxos e as poliamidas. ( BOEVER,1995; SCULLY,1997)
Sabe-se no entanto que a microbiota associada ao mau hálito é predominantemente anaeróbia e gram negativa.
A língua saburrosa é a principal causa de mau hálito, pois entre as papilas filiformes, ocorre a deposição de restos alimentares, restos de descamação celular e presenças de microrganismos. Estes metabolizam os alimentos e produzem o gás sulfídrico ( H2S ), a metilmercaptana ( CH3SH ) e o dimetil sulfeto, sendo estes os principais CSV. Produzem ainda o escatol e o indol, derivados dos aminoácidos aromáticos, além da cadaverina e da putrescina. Entretanto, os principais responsáveis pela halitose são mesmo os CSV pois as demais substâncias possuem alto peso molecular sendo insuficientemente voláteis para serem detectadas pelo olfato humano.
Acredita-se que a putrefação ocorra sob condições anaeróbias, envolvendo principalmente microorganismos GRAM negativos como Fusobactérias nucleatum, Aemophillos, Veionella alcalescens, Prevotella intermedia, Treponema dentícola, Porphyromonas gingivalis, Bacteriódes forcythus (ROSENBERG, 1996; SCULLY; et al., 1997).
Esses microorganismos têm a capacidade de produzir compostos sulfurados voláteis ( CSV ), considerados uma das principais fontes de halitose. Embora acredite-se que bactérias gram+ não produzam mau hálito, elas podem contribuir para o subsequente mau odor do dorso da língua, através do seu catabolismo (ROSENBERG, 1996).
Existem diversos métodos de avaliação da halitose disponíveis no mercado, sendo os principais o Halimeter e o Breath Alert.
O Halimeter, cujo objetivo é medir o grau de halitose é fabricado nos E.U.A. e, detecta a presença dos principais compostos sulfurados voláteis ( sulfidreto, metilmercaptana e dimetilsulfeto ) em ppb (partes por bilhão).
O Halimeter funciona quando os CSV atingem seu sensor, estes se ionizam gerando uma reação eletroquímica que libera elétrons, que por sua vez vão sensibilizar o circuito elétrico gerando uma corrente diretamente proporcional a concentração do gás ionizado. Esta corrente é convertida em voltagem para ser medida e assim é lida no visor digital do aparelho em partes por bilhão, ou seja, 1 grama de CSV para 1 000 000 000 de gramas de ar.
O Breath Alert, já comercializado no Brasil, por exemplo, é um método rápido, simples, barato e confiável, mas tem a desvantagem de não mensurar numericamente a “quantidade” de halitose e portanto dificultar o seguimento do tratamento dos pacientes.
As pessoas frequentemente não percebem o seu próprio hálito o que pode acarretar conseqüências desagradáveis como passar a vida toda sem perceber que é portador de mau hálito.
É importante ressaltar que em muitos casos a halitose é reversível, desaparecendo após a suspensão ou eliminação do agente causador, que tem atuação por um determinado tempo.
Classicamente o tratamento primário deve ser baseado no combate da causa que determina a produção de gases voláteis causadores do mau odor e complementação com higienização adequada. (TOMMASI, 1989).
Quando o mau hálito for devido a língua saburrosa, principal fonte do mau odor, o tratamento consiste na remoção da saburra por meio de raspadores ou limpeza da língua que removem os restos de alimentos e as bactérias contidas na língua, principalmente no dorso posterior onde a princípio a limpeza é mais difícil (KOLBE, 1999). Esses raspadores começaram a ser utilizados na Europa, no século XVIII à partir de 1770, feitos com casco de tartaruga ou marfim, que provocam abrasão.
Atualmente existem no mercado raspadores de aço inox ou de plástico injetado a base de poliestireno e até raspadores importados.
Os raspadores devem ser utilizados diariamente, após as refeições. Outra maneira simples de promover a limpeza lingual é através da escova dental. Além da limpeza da língua o paciente deve também, escovar os dentes, usar fio dental e enxaguatórios bucais, quando recomendado.
A utilização de bochechos com enxaguatórios químicos no combate a Halitose tem crescido nos últimos anos graças aos investimentos dos laboratórios nesse sentido. Assim recentemente vários enxaguatórios foram lançados no mercado, porém nenhum deles supera a eficácia clorexidina, um produto líder de mercado em Odontologia.
Os pacientes com boa saúde bucal, mas que possuam halitose de provável origem geral devem ser encaminhados ao médico para um correto diagnóstico. Independente da causa da halitose é imperativo que além da escovação dental, se promova a limpeza lingual periódica, principalmente após as refeições e ao deitar, quando o acúmulo bacteriano é maior.
MATERIAL E MÉTODOS
No presente estudo foram comparados os métodos de higienização da língua, através de higienização mecânica com raspadores linguais e bochechos com clorexidina a 0,12%. Para esse objetivo foram selecionados 200 pacientes adultos de ambos os sexos, das raças branca e não branca, todos portadores de halitose oriundos da Clínica Odontológica da Universidade Guarulhos – UnG.
O diagnóstico de halitose foi realizado pelo Halimeter, que detecta a presença de Compostos Sulfurados Voláteis ( CSV ) e os quantifica em Partes por Bilhão (ppb ). Os principais compostos sulfurados são o sulfeto, a metilmercaptana e o dimetilsulfeto.
Objetivando resultados comparativos os 200 pacientes foram divididos em 2 grupos de 100, sendo um grupo do sexo masculino e outro do sexo feminino, que apresentavam semelhança de condições bucais, alimentares e físicas.
Para esse fim, todos foram submetidos a exame clinico detalhado, evitando-se fatores interferentes. Todos os participantes foram informados sobre os objetivos da pesquisa, ou seja, a eficácia de métodos de higienização mecânico feita pelos raspadores linguais de plástico e químicos representados pela clorexidina a 0,12%.
Quanto a divisão dos pacientes em raça branca e não branca é mister informar que não houveram conclusões conflitantes, motivo pelo qual esse fato não será considerado no presente estudo.
A opção pelo uso de raspadores e clorexidina foi baseado na crescente popularização desses produtos e por serem amplamente comercializados. Para a utilização da aferição da halitose pelo Halimeter, foram seguidas as orientações do fabricante e seus mecanismos de funcionamento foram abordados na introdução.
Antes de iniciar o processo de higienização da língua pelos raspadores linguais de plástico e a clorexidina a 0,12%, todos os pacientes foram submetidos a aferição de da halitose pelo Halimeter para a detecção dos CSV. Após a aferição da halitose, os 2 grupos ( 100 homens e 100 mulheres ) iniciaram o processo de higienização preconizados pelo prazo de 30 dias utilizados após as refeições, não sendo descartados os métodos habituais de higiene.
Inicialmente as mulheres foram submetidas ao método químico e os homens ao processo mecânico. Terminados os 30 dias os participantes foram novamente submetidos ao Halimeter, a fim de avaliar a diminuição ou não dos Compostos Sulfurados Voláteis ( CSV ). Após essa mensuração os 2 grupos foram orientados a não realizar os métodos estabelecidos, continuando somente com a higienização habitual, por um período de 30 dias, chamado de Período de Repouso (PR), cujo objetivo seria de constatar a atuação e eficácia dos métodos estabelecidos.
Concluindo o período de repouso todos foram novamente orientados a iniciar os métodos de higienização anteriormente realizados por mais 30 dias e nova aferição foi realizada após esse período. Foi realizado repouso entre as etapas de 7 e de 15 dias para inversão do protocolo.
Posteriormente numa segunda etapa os protocolos foram os mesmos, invertendo-se os métodos higiênicos utilizados pelos grupos. Assim nessa fase os homens passaram a utilizar o método químico da clorexidina a 0,12% e as mulheres passaram a fazer uso do método mecânico representado pelo raspador lingual de plástico.
É importante ressaltar que durante a pesquisa não houveram intercorrências prejudiciais ao trabalho. Os raspadores linguais e a clorexidina a 0,12% utilizados são os mesmos encontrados no comércio, sendo todos da mesma marca e do mesmo tipo. Todos os resultados obtidos antes e ao final de cada etapa foram anotados em prontuários especificamente idealizados para esse fim. Cabe reiterar que a totalidade dos pacientes integrantes da pesquisa eram portadores de halitose com níveis acima de 70ppb, considerado este o limite de normalidade na presença de compostos sulfurados voláteis.
Quando da avaliação inicial, antes dos inícios das etapas, os níveis encontrados variavam de 90 até 414 ppb. As mensurações eram realizadas em todos os pacientes simultaneamente no mesmo dia e horário, respeitando-se como já se disse as recomendações do fabricante. Para a tabulação dos dados, optou-se pela não utilização das casas decimais, para facilitar a leitura.
Para fins didáticos a halitose foi dividida em níveis chamados de LEVE-LE (71 a 130 ppb), MODERADO-MO (de 131 a 250 ppb) e GRAVE-GR (acima de 251 ppb).
Os métodos de higienização utilizados seguiram as recomendações de uso dos fabricantes e todas as precauções foram tomadas para se evitar efeitos colaterais indesejáveis.
RESULTADOS E DISCUSSÃO
A presente pesquisa fundamentou-se na eficácia de métodos preventivos ou curativos de higienizaçao da língua realizada pelos raspadores linguais (RL) e clorexidina 0,12% (BCL). O estudo foi realizado em 200 pacientes, sendo 100 do sexo masculino e 100 do sexo feminino divididos em 02 grupos. Os grupos foram submetidos aos métodos preconizados durante um período de 30 dias e repouso de mais 30. Esse método foi realizado 02 vezes por cada grupo, alternando-se posteriormente os métodos por igual período. Assim ambos os grupos foram submetidos pelo mesmo tempo aos critérios estabelecidos. Vale lembrar que todos os participantes eram portadores de halitose mensurada pelo Halimeter e a cada início e término de cada etapa o hálito era aferido e anotado.
Lembramos que entre a primeira e segunda fase do mesmo método foi dado um descanso de 07 dias, enquanto na alternância de métodos esse período foi de 15 dias.
Objetivando facilitar a interpretação dos dados obtidos, julgamos de boa norma apresenta-los resumidamente sob a forma de tabela simples e comparativa através de valores percentuais. A média de idade dos pacientes do sexo feminino foi de 31 anos e para o masculino foi de 34 anos.
Sexo feminino: bochechos com clorexidina 0,12% (BCL)
O diagrama 1 mostra que antes e durante a higienização e após o PR os níveis mantiveram-se inalterados. No entanto, após o processo de higienização o número de ppb caiu de 242 para 138, ocasionando uma melhora de 43,0%. A avaliação da halitose após o PR, revelou uma elevação dos níveis de halitose, porém inferior em 28,5%, comparado com o número inicial.
O diagrama 2 referente a segunda fase, pelo mesmo método demonstra uma avaliação inicial inferior a primeira fase em 20,3%, decaindo para 108 ppb após 30 dias com BCL, e uma redução de 21,7% se comparada com o mesmo processo da primeira fase. Comparativamente a avaliação da segunda fase foi significativamente melhor que a primeira fase, provocada provavelmente pela adaptação do método estabelecido.
Sexo masculino: bochechos com clorexidina (BCL).
O diagrama 7 reflete uma melhora de 17,4% entre a avaliação inicial (253 ppb) e após 30 dias de BCL (209 ppb), apesar da mudança de nível GR para MO. Após o período de repouso PR, o nível de ppb de CVS praticamente volta ao obtido pela avaliação inicial.
O diagrama 8, revela uma situação semelhante a tabela 7, demonstrando discreta redução em todos os períodos. Após 30 dias com BCL a melhora entre a primeira e a segunda etapa foi de apenas 6,2%.
Sexo feminino: raspador lingual (RL)
O diagrama 5 (primeira etapa); demonstra uma redução de CSV entre a avaliação inicial (231 ppb) e após 30 RL (127 ppb) de 45,0%, elevando-se novamente após o período de repouso (PR).
O diagrama 6 (segunda etapa); apresenta índices melhores que a tabela 5 em todas as fases. Entre a avaliação inicial 179 ppb e após os 30 dias (RL) a melhora foi de 54,7%, além da alteração de nível moderado(MO) para leve(LE). O percentual de redução de CSV entre após os 30 dias da primeira etapa e da segunda etapa foi de 36,2%.
Sexo masculino: raspador lingual (RL).
O diagrama 3 (primeira etapa); apresenta um nível GR na avaliação inicial e Mo após os 30 dias RL, promovendo uma melhora de 44,1%, elevando-se novamente após o PR.
O diagrama 4 (segunda etapa) demonstra resultados semelhantes aos obtidos pela tabela 3, havendo uma melhora ínfima de 4,8% dos resultados obtidos após os 30 dias entre a tabela 3 e 4, referente à conclusão do período de higienização.
DIAGRAMA I – SEXO FEMININO ( estudo comparativo entre a 1º e 2º etapa)
MÉTODO BCL
Aval. inicial Após 30 dias Após PR (30 dias)
242 ppb 43% 138 ppb 173 ppb
Moderada Moderada Moderada
28,5%
DIAGRAMA II – SEXO FEMININO ( 2A etapa )
20,3% MÉTODO BCL – 7 DIAS APÓS
Aval. inicial Após 30 dias Após PR (30 dias)
193 ppb 44% 108 ppb 125 ppb
Moderada Leve Leve
35,2%
DIAGRAMA III – SEXO MASCULINO ( estudo comparativo entre 1A etapa e 2º etapa)
MÉTODO RL
Aval. inicial Após 30 dias Após PR (30 dias)
297 ppb 44,1% 166 ppb 221 ppb
Grave Moderada Moderada
25,6%
DIAGRAMA IV – SEXO MASCULINO ( 2A etapa )
11,4% MÉTODO RL – 7 DIAS APÓS
Aval. inicial Após 30 dias Após PR (30 dias)
293 ppb 40% 158 ppb 181ppb
Grave Moderada Moderada
31,2%
DIAGRAMA V – SEXO FEMININO ( estudo comparativo entre a Iº e 2º etapa)
MÉTODO RL
Aval. inicial Após 30 dias Após PR (30 dias)
231 ppb 45% 127ppb 149 ppb
Moderada Leve Moderada
35,5%
DIAGRAMA VI – SEXO FEMININO ( 2A etapa )
22,5% MÉTODO RL – 7 DIAS APÓS
Aval. inicial Após 30 dias Após PR (30 dias)
179 ppb 54,7% 81 ppb 111ppb
Moderada Leve Leve
33%
DIAGRAMA VII – SEXO MASCULINO ( estudo comparativo entre 1A etapa e 2º etapa)
MÉTODO BCL
Aval. inicial Após 30 dias Após PR (30 dias)
253 ppb 17,4% 209 ppb 243 ppb
Grave Moderada Moderada
4%
DIAGRAMA VIII – SEXO MASCULINO ( 2A etapa )
0,8% MÉTODO BCL – 7 DIAS APÓS
Aval. inicial Após 30 dias Após PR (30 dias)
251 ppb 21,9% 196 ppb 239 ppb
Grave Moderada Moderada
4,8%
De forma ampla podemos observar que tanto o bochecho com clorexidina(BCL), como o uso de raspador lingual (RL), diminuíram o índice de halitose em todas as fases, após a aferição com o Halimeter®. Por outro lado, os melhores resultados foram obtidos durante a repetição dos métodos, com exceção do ocorrido na tabela V, onde o método de RL, foi discretamente superior na primeira fase (35,5%) em relação a segunda fase (33%), referente ao sexo masculino.
Um fato que chama a atenção é o melhor desempenho do sexo feminino em relação ao sexo masculino, em todas as fases e métodos, particularmente no tocante ao método de BCL, onde o percentual de melhora da halitose no sexo feminino é significativamente maior que no sexo masculino. Outra situação a ser considerada é que os indices de halitose inicial e final no sexo masculino foram superiores. Esse fato pode ser explicado pela maior vaidade e determinação observada no sexo feminino com relação a saúde.
Quanto aos métodos de higiene aplicados BCL e RL, o método mecânico realizado pelo RL, mostrou-se mais eficaz na grande maioria das vezes. Nesse sentido, é sabido que os métodos mecânicos de higienização bucal, produzem melhores resultados quando comparados com procedimentos químicos. No sexo masculino, por exemplo, o uso de RL, provocou uma melhora em relação a halitose inicial de 31,2% na segunda etapa, contra uma redução da halitose de apenas 4,8% na mesma fase pelo método de BCL. A presente pesquisa ratifica que a higienização da língua reduz consideravelmente a halitose.
CONCLUSÕES
A presente pesquisa permite aos autores as seguintes conclusões:
- A saburra lingual é a principal fonte de halitose local.
- O Cirurgião Dentista precisa conhecer os métodos de combate a halitose e estar capacitado a diagnosticar e eventualmente tratar esse grave problema.
- Os melhores resultados no combate a halitose foram obtidos no sexo feminino
- Na presente pesquisa os raspadores linguais(RL), se mostraram mais eficazes no combate a halitose quando comparados ao bochechos com clorexidina 0,12% (BCL).
- A segunda etapa de todos os métodos mostraram melhores resultados.
- O correto exame clínico e a escolha do tratamento é fundamental na obtenção de resultados satisfatórios.
ABSTRACT
The halitosis or bad breath is a disease and need treatment. It is a limiting factor for the social contacts and is very prejuditial for professional and social relationships.
The causes of halitosis are associated with a lot of factors. Sistemic or local factors, with predilection for the locals, and the hairy tongue is the most important cause of the bad breath. In this research we discuss the mechanic and chemical methods against halitosis in 200 adult patients from the dentistry clinic of Guarulhos University. To confirm the clinical diagnostic of halitosis the authors used a high precision machine called Halimeter to detect the CSV in the mouth.
KEY WORDS
Halitosis – Bad Breath – Hairy tongue
REFERÊNCIAS BIBLIOGRAFICAS
- ADDE, C. A.Como os povos antigos tratavam dos dentes ? Já havia instrumentos ? Revista Galileu ano 9 n.º 97, pg. 17, ago 1999
- BOELTER, R.. Halitose. http:// www.webspace.com.br/ boelter
- BOEVER, E. H.; LOESCHE, W. J.. Assessing the contribution of anaerobic microflora of the tongue to oral malodor. JADA. 126(10): 1384/1393, oct. 1995.
- CARLSON-MANN, L.. The use of tongue cleaners in the treatment of halitosis. PROBE. 32(3): 114/115, may/june 1998.
- CERRI, A.; MARTI, D. P. HALITOSE : ESSE PROBLEMA TEM TRATAMENTO ? Revista Brasileira de Cirurgia da Cabeça e Pescoço, SÃO PAULO, v. 24, n. 3, p. 91-96, 2000
- CHRISTENSEN, G. J.. Porque limpar sua língua? JADA – Brasil. 2(1):74/76, fev. 1999.
- CONCEIÇÃO, M. D.. Tratamento da halitose. e-mail: mdc@correionet.com.br
- DICINÁRIO DA LÍNGUA PORTUGUESA: Jornal da tarde. São Paulo, 1993.
- GOLDBERG, S.. Isolation of Enterobacteriaceae from the mouth na potential association with malodor. J. Dent. Res. 76(11): 1770/1775, nov. 1997.
- HOCKMAN, M. J.. Halitosis. J. Dent. Assoc. S. África. 51(3): 130/131, mar. 1996.
- KOLBE, A. C.. Kolbe limpador de língua. http: // www.svn.com.br/kolbe/
- KOZLOVSKY, A.; GOLDBERG, S.; NATOUR, I.; ROGATKI-GAT, A.; GELERNTER, I.; ROSENBERG, M.. Efficacy of a 2-phase oil: Water Mouthrinse in controling oral malodor, gingivite and plaque. J. Periodontol. 67(6): 577/582, jun. 1996.
- PENTEADO, J. F.. Halitose. http://www.riogastro.com/saúde/hálito.htm
- RODARTE, I.. Halitose. http://www.iis.com.br/~riocopa/halitose.htm
- ROSENBERG, M.. Clinical Asseessment of bad breath: current concepts. JADA. 127(4): 475/482, apr. 1996.
- SCULLY, C.; EL-MAAYTAH, M.; PORTER, S. R.; GREENMAN, J.. Breath odor: etiophatogenesis, assessment ag management. European Journal of Oral Sciences. 105(4): 287/293, dec. 1997.
- SPIELMAN, A. I.; BIVONA, P.; RIFKIN, B. R.. Halitosis. A common Oral Problem. New York States Dental Journal. 62(10): 36/42, dec. 1996.
- TOMMASI, A. F.. Diagnóstico em Patologia Bucal. Ed. Pancast. 2º ed. pg.28/32, 1989.
End do Autor:
Prof. Dr. Artur Cerri
Aspectos clínicos e histológicos en la queilitis actínica crónica, su relación con el Virus del Papiloma Humano
Revista Odontoestomatologia / Vol XIII, Nr 17, Mayo 2011, Uruguay
Prof. Dr. Francisco Octávio Teixeira Pacca
Prof. Dr. Gilberto Marcucci
Prof. Livre Docente Fabio Daumas Nunes
Prof. Dr. Carlos Eduardo Xavier dos Santos Ribeiro da Silva
Prof. Dr. Artur Cerri
Resumen
Los virus del papiloma humanos (HPVs) oncogénicos son importantes agentes en la etiología del cáncer ginecológico y actualmente han sido relacionados también a algunas lesiones carcinógenas y a algunos tipos de cánceres de boca. Con el objetivo de evaluar la presencia del HPV en la queilitis fueron evaluados y considerados aptos para el estudio 29 pacientes portadores de QAC y 29 pacientes en el grupo control. Se utilizó la PCR para detectar la presencia del HPV en muestras de tejido fresco, provenientes de labios enfermos. La QAC ocurrió en individuos de raza blanca, 19 hombres y 10 mujeres, con media de edad 56 años. En el análisis de las características clínicas se registraron muchas alteraciones. También se evaluaron los aspectos histológicos de la QAC y se encontraron atipia en diferentes grados en todos os casos. Concluimos que todos los casos presentaron resultados negativos del aislamiento viral.
Abstract
ABSTRACT
Human papilloma viruses (HPVs) are important oncogenic agents in the etiology of gynecologic cancer and now have been linked to some pre-malignant lesions and some types of oral cancers. In order to assess the presence of HPV in the cheilitis were used for the study 29 patients with QAC and 29 patients in the control group. PCR was used to detect the presence of HPV in samples of fresh tissue from diseased lips. The QAC occurred in Caucasians, 19 males and 10 females, mean age 56 years. In the analysis of the clinical features were recorded many alterations. We also evaluated the histologic features of the QAC and atypia were found in varying degrees in all cases. We conclude that all cases had negative results for viral isolation.
Palabras-claves: Papilomavirus humano, HPV, queilitis actínica crónica
Key words: Human Papillomavirus, HPV, chronic actinic cheilitis
1. Introducción
El papilomavirus humano (VPH) es un virus del género Papillomavirus, perteneciente a la familia Papillomaviridae, con más de 200 tipos identificados, algunos de estos responsables por las verrugas vulgares, anogenitales e incluso papilomas en la cavidad bucal y en la nasofaringe (SILVA et al., 2007). Su principal vía de transmisión es la sexual, tanto en hombres como en mujeres, pero existe también la posibilidad de transmisión por otras vías como la sanguínea, el canal de parto, por besos y por objetos contaminados (1).
Se estima que entre un 10% y un 40% de la población sexualmente activa se infecta con uno o más tipos de de VPH, siendo que la mayor parte de estas lesiones es transitoria. Está establecida y demostrada su presencia en la génesis del cáncer cérvico-uterino gracias a los innúmeros trabajos de investigación publicados (2).
En la mucosa bucal el VPH se asocia principalmente al papiloma y raramente a la presencia de verrugas vulgares o condiloma acuminado. Algunos autores han asociado la presencia de VPH, en particular los subtipos 16 y 18, como factor que contribuye a la aparición del Carcinoma Espino-Celular (CEC) de boca (3). Aun así, el VPH no actúa en forma aislada en la oncogénesis. Otros factores tales como el estado inmunológico del paciente, el estado nutricional, la predisposición genética, la exposición solar, el tabaquismo y el alcoholismo actúan en conjunto favoreciendo la instalación de la neoplasia. Cabe resaltar que la asociación de estos factores a los subtipos de VPH denominados de “alto riesgo” es de extrema relevancia en la génesis de las neoplasias malignas.
El estudio de las lesiones cancerizables, del cáncer de boca y sus factores desencadenantes cada vez es más discutido. Sabemos que en Brasil el tipo de cáncer de boca más común es el CEC de labio (1) y su relación con la Queilite Actínica Crónica (QAC) ya está debidamente comprobada (4).
Clínicamente, la QAC ocurre predominantemente en individuos que superan los cuarenta años, leucodermas, del sexo masculino, y que se exponen continuamente a rayos solares, como pueden ser agricultores, marineros, pescadores, cuida-coches, obreros de construcción y otros. Su ubicación es más frecuente en el labio inferior, ya que este permanece anatómicamente más expuesto a la acción dañina de los rayos solares (5).
Clínicamente el labio con QAC puede presentar las siguientes alteraciones: descamaciones, resecamiento, fisuras, adelgazamiento del labio inferior, eritemas, edema, zonas blanquecinas, ausencia de límite en la línea de transmisión entre el labio inferior y la piel, costras, pérdida de elasticidad, ulceraciones y desangramiento (4).
La QAC puede presentar las siguientes alteraciones histológicas: polaridad nuclear alterada, relación citoplasma aumentada, hiperplasia de las células basales, núcleos hipercromáticos, mitosis anormales, ortoqueratosis, paraqueratosis, maduración epitelial alterada, cohesión celular reducida, degeneración del colágeno (elastosis), infiltrado inflamatorio, ulceración, vasodilatación, acantosis, y atrofia epitelial (6).
La radiación solar es el agente etiológico de la QAC y del cáncer de labio, a pesar de que se conozca que la probabilidad de malignización puede ser más elevada cuando asociada a otros factores carcinogenéticos (4).
Czerninski, Zini y Sgan-Cohen en 2010 (7) describen al cáncer de labio y distinguen a los factores de riesgo entre endógenos (xerodermia pigmentosa, avitaminosis e inmunosupresión) y factores exógenos (radiación solar, tabaco, clima seco, alcohol, infección herpética recurrente, infecciones por VPH y traumas). Algunos estudios intentan relacionar la acción de los oncovirus con el cáncer de labio (8).
Existe la necesidad de estudios más sofisticados por medio de la biología molecular en relación al cáncer de labio, las lesiones cancerizables y VPH. Se ha observado que la bibliografía científica carece de trabajos que aclaren más en detalle a una eventual relación del VPH con las lesiones cancerizables y especialmente con la QAC. Tales hechos nos permiten investigar la asociación del VPH y la QAC. (9)
2. Antecedentes
Algunos trabajos intentan cuantificar el porcentaje de malignización del QAC a CEC; estos resultados varían entre un 12% y un 20% (1). De cualquier manera el porcentaje es preocupante y hace del temprano diagnóstico una herramienta fundamental. Huber y Terezalmy (2006) (4) sostienen que el potencial de malignación puede incluso sobrepasar el 20% y enfatiza la importancia de biopsiar todos los casos de QAC.
La infección mediante VPH es la enfermedad sexualmente transmisible (ITS) que más se presenta entre la población adulta, siendo innegable su íntima relación con la presencia de las neoplasias malignas uterinas, ya que según algunos autores, pueden estar presentes en hasta un 100% de las pacientes portadoras de cáncer de cuello de útero (10).
La bibliografía en relación al VPH y su correlación con las neoplasias bucales aún es escasa, y además sus resultados muchas veces resultan contradictorios. Tal discrepancia puede atribuirse principalmente a la variedad de metodologías aplicadas a las investigaciones y a la diversidad de los grupos epidemiológicos examinados.
Fueron evaluados a través del PCR al VPH en tejidos parafinados a 49 casos de pacientes con lesiones cancerizables en mucosa oral, siendo 10 casos de eritroplasias, 11 casos de leucoplasias homogéneas, 16 casos de leucoplasias nodulares y 12 casos de eritroleucoplasias, donde se concluye: el VPH se encontró en 62,5% de las leucoplasias nodulares, en un 50% de las eritroplasias, en un 45,5% de las leucoplasias homogéneos y en 33,5% de las eritroleucoplasias. En este mismo trabajo, los autores investigaron al VPH en la mucosa normal de 20 pacientes, y no detectaron la presencia del virus en ningún caso.(11)
Fue realisado un análisis retrospectivo de 4680 muestras de tejidos parafinados y frescos, de donde obtuvieron una presencia de VPH en un 10% de los casos de mucosa bucal normal, 22,2% en los casos de leucoplasia, 26,2% en los Carcionomas intra-epiteliales (CEC in situ), 29,5% en los Carcinomas Verrugosos y finalmente 46,5% en los casos de CEC. Estimaron también la probabilidad de detección de VPH en lesiones leucoplasicas entre dos a tres veces mayor que en la mucosa normal, mientras que para el CEC, esta posibilidad aumentaría a aproximadamente 4,7 veces. Concluyendo su estudio, afirmaron que la presencia de VPH, en particular los subtipos denominados de “alto riesgo” como el 16, 31, 33, 35, 39, 45 y 52 son factores importantes para considerarse en la génesis del cáncer bucal. (12)
Fueron avaluados un total de 60 pacientes, donde 40 presentaban lesiones epiteliales benignas (papilomas, condilomas, verrugas vulgares e hiperplasias epiteliales focales) y 20 presentaban mucosas bucales dentro de padrón de normalidad, todos sometidos al examen de PCR para tejido fresco, de los cuales se obtuvieron los siguientes resultados: la mucosa normal presentó una ocurrencia de PVH en 10% de los pacientes, siendo los subtipos encontrados el 6 y el 16, mientras que en las muestras de los pacientes con lesión, este porcentaje alcanzó al 55% de los casos, donde fueron encontrados además de estos los subtipos 13 y el 32. (13)
Fueron examinados 333 pacientes normales y encontraron una predominancia de PVH de 11,1% en la mucosa bucal, mientras que en el examen de 202 pacientes con CEC, este porcentaje llegó al 28,7%. Los subtipos encontrados fueron el 16, 18, 31, 33 y el 58. Todos los diagnósticos se valieron del examen de PCR en tejidos parafinados. (14)
Muestras de CEC bucal originales de bloques de parafina fueron examinados, encontrando el VPH en un 42% de los casos, con predominancia del subtipo 16 (66,6%).(15)
En Japón, Mitsuishi et. al en el 2005, realizaron la investigación utilizando la técnica PCR para el VPH del tejido fresco en pacientes portadores de carcinomas verrugosos de labio encontrado positivamente en un 74,8% de los casos. Al mismo tiempo, Shimizu et al en el 2004 investigaron también mediante PCR para tejido fresco la presencia del VPH en 27 pacientes con CEC de labio y en 30 pacientes normales, encontrando positivamente para el VPH en un 18% (cinco casos) de los pacientes con CEC y un 33% (10 casos) de los pacientes de labio normal. (8)
En un estudio desarrollado por el Instituto Pasteur (París), identificaron la presencia del VPH, por el examen de PCR en tejido fresco, en: 2 pacientes de una muestra de 40 portadores de QAC (5%) y en 1 paciente de una muestra de 25 portadores de CEC de labio (4%). (16)
En Alemania, fueron investigados también con la técnica del PCR en tejido fresco la presencia del VPH 16 y 18 en 118 casos de CEC, 72 leucoplasias, 12 queilites actínicas crónicas y 65 líquenes –plano. Se verificó la presencia de los grupos virales en un 43,2% de los CEC, 22,2% de las leucoplasias, 25,0% de las queilites y 15,4% de los líquenes -plano.(17)
3. Objetivo
Los objetivos del presente trabajo son :
– Determinar la presencia del VPH en la Queilitis Actínica Crónica y en la semimucosa labial normal.
– Correlacionar los aspectos clínicos e histológicos de la Quiilitis actínica crónica con y sin la presencia del VPH.
4. Metodología (CASUÍSTICA Y MÉTODOS)
Se han seleccionado para el estudio a 60 pacientes distribuidos en dos grupos:
Grupo enfermo: 30 pacientes portadores de QAC en el labio inferior, que fueron atendidos en Estomatología de la Facultad de Odontologia de la Universidad de São Paulo.
Grupo control: 30 pacientes sin evidencia de lesiones tipo QAC en el bermellón del labio inferior.
Fue presentado y firmado por los pacientes una formulario de consentimento informado libre y con las directrices sobre la realización de la investigación. El examen clínico y la atención al paciente, se realizó en la consulta externa de la Universidad de São Paulo. El trabajo científico ha sido aprobado por el Comité de Ética de la Universidad.
Los grupos fueron dispuestos de acuerdo al género, la edad y la etnia. Los pacientes, tanto del grupo enfermo como del grupo de control, se sometieron a la remoción de un pequeño fragmento de tejido utilizándose para ese fin un punch número 2 (diámetro de 2 mm). El material escogido fue dividido en dos fragmentos, siendo acondicionado en formol a 10% para la realización del examen histopatológico con una coloración en hematoxilina y eosina (HE) y lo otro en un tubo de eppendorf conteniendo a 10 µl de proteínas K tapada en la concentración 500µg/ml para la realización del examen de PCR. Los aspectos histológicos de las QAC fueron interpretados siguiendo la clasificación de la displasia epitelial de Van Der Waal (1986), que analiza los siguientes hallazgos histológicos: 1 relación núcleo citoplasma aumentada, 2- polaridad nuclear alterada, 3-hiperplasia de las células basales, 4- núcleos hipercromáticos, 5- mitosis anormales, 6- maduración epitelial alterada, 7- cohesión celular reducida, 8- queratinización alterada, 9- nucleolos aumentados. La graduación de la atipia fue oficializada por la Organización Mundial de la Salud (OMS) en 1978 que clasificaron como leve, cuando dos hallazgos histológicos estaban presentes; moderada, cuando tres o cuatro de esos hallazgos histológicos eran notados; severa, cuando cinco o más hallazgos histológicos estaban presentes. Otros aspectos histológicos se presentan en los casos de QAC, como: degeneración del colágeno (elastosis) infiltrado inflamatorio, vasodilatación, acantosis y atrofia, pero estas características no son tenidas en consideración por Van Der Waal (1986) en su clasificación (18)
Reacción de PCR para VPH
Se agregaran para la detección del VPH un Kit prefabricado por la empresa Biotools llamado Biopap que además de detectar la presencia del virus, determina por el peso molecular si el VPH en cuestión es del grupo oncogenético (subtipos variables que poseen 450 pares de base (pb) HPV 6, 11, 13, 30, 32, 34, 39, 40, 42, 43, 44, 45, 51, 53, 54, 55, 56, 57, 59, 61, 62, 64, 66, 67, 68 e 69). (9)
De lo subtipos mencionados, los genotipos de alto riesgo son 16 y 18 y los genotipos de riesgo moderado son el 10 y 11.
Con este objetivo, seguimos los siguientes pasos: efectuamos la digestión proteica de las partes acondicionadas en los tubos de eppendorf y después promovemos la extracción del ADN, que era disuelto en 30µl de tapón de resuspensión y conservado a -20°C hasta la cuantificación y utilización para el PCR.
Descongelamos las muestras y los reactivos del Kit por 10 minutos a temperatura ambiente y en otro de eppendorf colocamos: 0,5µl de Taq ADN polímeros; 18,75 µl de HPV mezcla reactiva ; 0,75 µl de MgCl2 e 3,0 µl de H2O bidestilada (agua Mili-Q).
Con estas proporciones, llegamos a 23 µl en cada tubo, con el objetivo de totalizar 25 µl en cada tubo y finalizar la preparación del material, se han estudiado a los siguientes procedimientos: para el control positivo, se agregaron 2µl del control del Kit; para el control negativo, aumentamos 2µl de agua Mil-Q y en las muestras testeadas, aumentamos 2µl de ADN de las muestras. Colocamos los eppendorfs en la centrifugadora respetando los ciclos recomendados por la Biotools. Para someter las muestras en el cubo electroforesis utilizamos gel de agarosa 2% sumados a 3,0µl de bromuro de etilo. Cada muestra analizada por el examen de PCR contenía 10µl de ADN que se agregó en 1µl de azul de bromoferol. Estas soluciones eran colocadas en los correspondientes casulos del gel de agarosa y sometidas a electroforesis por 30 minutos a 90 voltios con posterior análisis de los resultados en transiluminador con lámpara ultra-violeta
Criterios adoptados para la interpretación de los resultados del PCR para el VPH
A través de la lectura de las bandas iluminadas por el transiluminador con la lámpara ultravioleta se pudo determinar la amplificación o no del ADN del virus PVH en las muestras. Usamos como referencia un marcador de peso molecular (Lox DNA Mass Ladder Invitrogen), un control positivo (C+) que mostraba las bandas iluminadas en la región de 250pb para el grupo oncogénico y 450 pb para el grupo no oncogénico como también un control negativo (C-) (Fig. 1).
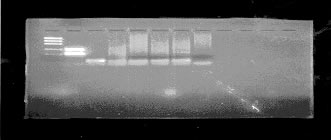
LM C+ C- 1 2 3 4 5
250 pb
450 pb
Fig. 1: ejemplo de 5 casos negativos de nuestro estudio
Comprobación de la integridad del ADN en estudio
Con el objetivo de comprobar la integridad del ADN en estudio, sometemos a todas las muestras negativas al examen de PCR al VPH a otro examen de PCR, para evaluación de la presencia de un gen de desarrollo denominado HOXB1. HOXB1 es un gen con secuencia presente en el ADN de todas las células, por lo tanto la positividad de este PCR al HOXB, garantiza que el ADN en estudio esté íntegro y viable para la investigación. Para la reacción de PCR a HOXB1, utilizamos un Kit de primers y reagentes descritos por LEWIS (19).
En el presente trabajo sólo se utilizaron para el estudio los casos que muestran amplificación PCR del HOXB1. En cada muestra fueron sumadas 1µl de azul de bromoferol y sometidas al cubo de electroforesis en gel de agarosa en 1% (para cada 80 ml de tapón electrolítico (TBE) 0,8 g de agarosa) y tampón electrolítico por 30 minutos a 90 voltios (siguiendo el mismo protocolo que se utilizó en el examen de PCR para el VPH). Los resultados fueron evaluados en el transiluminador con luz ultravioleta. Usamos como referencia un marcador de peso molecular, un control positivo que mostraba la banda iluminada en la región de 576 pb y un control negativo.
5. Resultados
Analizando los 60 casos estudiados (30 con queilitis y 30 labios normales), 58 muestran positivos para el PCR del HOXB1, y dos casos se muestran negativos, siendo uno de cada grupo. De esta manera nuestro estudio tiene una muestra viable para la investigación de 29 casos para QAC y 29 casos para labio normal (Fig. 4).
Evaluación clínica de los pacientes involucrados en la investigación, se observó que de los 29 pacientes con QAC, 19 son hombres y 10 son mujeres. Con el objetivo de disponer a nuestro grupo de control, incluimos para el estudio también a 29 pacientes, siendo estos 19 hombres y 10 mujeres. La media de edad semejante al del grupo con QAC (56 años para el grupo protador de QAC y 55 años para el grupo de control)
Todos los pacientes con QAC han sido evaluados, alcanzando los siguientes resultados: Resecamiento – 29 casos (100% de los casos); Alteración de la línea de transición entre la piel y bermellón del lábio – 27 casos (93,10% de los casos), Descamación – 23 casos (79,31% de los casos); Eritemas – 23 casos (79,31 % de los casos); Adelgazamiento de bermellón – 22 casos (75,86 de los casos); Áreas leucoplasicas – 18 casos (62,03 de los casos); Fisuras -16 casos (55,17% de los casos); Elastosis labial – 16 casos (55,17% dos casos); Costras – 9 casos (31,03% de los casos); Ulceraciones – 7 casos (24,13% de los casos); Edema – 3 casos (10,34% de los casos; Sintomatología (dolor– 2 casos (6,89% de los casos); Sangrado 1 caso (3,44% de los casos).
En la siguiente ilustración, puede ver uno de los casos de nuestro trabajo, donde algunos de los aspectos clínicos, pueden ser percibidos. (Fig. 2)
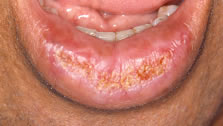
Figura 2: Ejemplo de QAC en nuestro estudio (caso 22) que muestra resecamientos, alteración de la línea de transición, edema y elastosis labial, áreas eritematosas, úlceras y crostras, fisuras, adelgazamiento de bermellón y La presencia de algunas zonas leucoplasicas
B) Evaluación histológica. Se confirmó el diagnóstico clínico de QAC, siendo los resultados clasificados como QAC discreta, moderada y severa, según dependencia de los niveles de atipia epitelial encontrados.
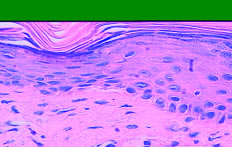
De los 29 casos biopsiados, relevamos los siguientes resultados: -14 casos de QAC con atipia epitelial discreta (48,27% de los casos); – 10 casos de QAC con atipia epitelial moderada (34,49% de los casos); – 5 casos de QAC con atipia epitelial severa (17,24% de los casos). En la siguiente ilustración, puede ver uno de los casos, donde algunos de los aspectos histológicos, pueden ser percibidos. (Fig. 3)
Fig. 3: Ejemplo del QAC en nuestro estudio (caso 09) que muestra una atipia epitelial leve, que se encuentra principalmente la polaridad celular y queratinización alterada y la atrofia del epitelio. (Aumento de 400 x)
En las láminas estudiadas no se observaron inclusiones virales (coilocitosis).
Como ya se ha, el HOXB1 es un gen presente en todo el ADN, por lo tanto la positividad de este examen de PCR para el HOXB1, garantiza que el ADN en todo estudio está íntegro y viable para investigación. En nuestro trabajo, sólo fueron considerados los resultados que se muestran positivos para el PCR del HOXB1 (Figura 4).
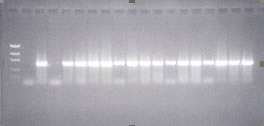
Figura 4: imagen del PCR para o HOXB1. Observar el control de peso molecular en la primera columna, el control negativo en la segunda columna, el control positivo en la tercera columna, uno de los casos que se negativizó en la cuarta columna y el restante de las columnas todas positivas.
6. Discusión
Huber y Terezhalmy en 2006 (4), consideran la etnia como a uno de los factores de riesgo de QAC y el Cáncer de labio. En nuestro trabajo, verificamos que 100% de los pacientes con QAC era de etnia blanca.
Recientes trabajos describen la vigencia de la QAC ocurriendo (como acometiendo principalmente) en pacientes de más de cinco décadas de vida. Estos datos fueron confirmados en nuestra investigación, pues observamos un promedio de edad en nuestros pacientes portadores de QAC de 56 años.
Aguiar (2006) (20) fue la primera referencia en bibliografía en analizar algunos aspectos clínicos de la QAC de forma muy detallada. En su estudio se evaluaron 69 pacientes con QAC, alcanzando los siguientes resultados: eritema en 71,01% (en nuestro estudio encontramos un 79,31%), descamación en 69,56% (en nuestro estudio 79,31%) ulceración en 15,94% (en nuestro estudio 24,13%) infiltración o elastosis en 40,57% (en nuestro estudio 55,17%), costra en 13,04% (en nuestro estudio 31,03%), atrofia o disminución del labio inferior en 71,01 (en nuestro estudio 75,86%), áreas leucoplásicas en 37,68% (en nuestro estudio 62,06%), alteración en la línea de transición entre piel y labio inferior en 88,40% (en nuestro estudio 93,10%). Percibimos de manera general en nuestros pacientes las alteraciones clínicas encontradas fueron mas frecuentes.
En el 2008 Cavalcante, Anbinder y Carvalho (6) analizaron también a 29 pacientes con QAC verificando los grados de atipias celulares encontradas. Todos los casos presentaron atipia epitelial en las siguientes proporciones: atipia leve en 10,35%, atipia moderada en 27,59 y atipia severa en 62,06% de los casos. Es interesante comparar éstos resultados, pues estos son absolutamente antagónicos a los de nuestro estudio; pues en nuestros pacientes encontramos un 48,27% de atipas discretas, 34,49% moderadas y 17,24% de atipas severas. Esta variación puede ser justificada una vez evaluado el perfil de los pacientes del trabajo de Cavalcante.
Nielsen, Norrild e Vedofte (1996) (11), evaluaron a través del PCR en tejido fresco la mucosa labial de 20 pacientes normales y no detectaron la presencia del VPH en ningún caso.
En relación a la evaluación de posibles infecciones virales por el VPH, en nuestros pacientes, se ha observado con mucha atención la morfología celular del epitelio analizando los aspectos de posibles coilocitosis (vacuolos citoplasmáticos con núcleos pictónicos y extensos halos claros, displasiales nucleares, binucleación e inmadurez atípica) (21).
7. Conclusiones
Los resultados obtenidos por medio de las metodologías utilizadas por nosotros, nos permiten concluir que:
En las muestras analizadas en este estudio no se ha detectado la presencia del VPH en el grupo portador de QAC (19 hombres y 10 mujeres) ni en el grupo control (29).
La QAC ocurrió en individuos de etnia blanca, del género masculino con una media de edad de 56 años.
En el análisis de las característica clínicas se registraron: resecamiento en 29 casos (100%), alteración de la línea de transición en 27 casos (93,10%); descamación en 23 casos (79,31%), eritema en 23 casos (79, 31%); Adelgazamiento de bermellón en 22 casos (75,86%), áreas leucoplasicas en 18 casos (62,06%); fisuras en 16 casos (55,17%); elastosis labial em 16 casos (55.17% ), costras en 9 casos (31,03%), ulceraciones en 7 casos (24,13%), edema en 3 casos (10,34%); sintomatología en 2 casos (6,89%), sangrado en 1 caso (3,44%).
Los aspectos histológicos muestran que de los 29 pacientes estudiados se encontraron atipia discreta en 14 casos, moderada en 10 y severa en 5 casos
Es importante destacar que las infecciones por VPH aisladamente no son capaces, por sí mismas, de inducir progresión a neoplasia maligna. De hecho, se cree hoy en día que existe la concomitancia de otros eventos moleculares para el seguimiento del fenotipo invasor. Se considera que a través de la metodología de la biología molecular, muchas de estas cuestiones podrán solucionarse
8. REFERENCIAS
1. Pacca FOT, Marcucci G, Nunes FD, Silva CEXSR, Cerri RA, Cerri A. Queilite Actínica Crônica, estudo e correlações dos aspectos clínicos e histopatológicos. Rev Assoc Paulista Cir Dent. Dez 2009 V.63 n.6.: 445-452.
2. Dunne EF, Markowitz LE.Genital human papillomavirus infection. Clin Infect Dis 2006;43(5)624-9.
3. Koppikar P, Villiers EM, Mulherkar R. Identification of human papillomaviruses in tumors of the oral cavity in an Indian community. Int J Cancer 2005;113(6):946-50.
4. Huber MA, Terezhalmy GT. The pacient with actinic cheilosis. Gen Dent 2006;54(4):274-82.
5. Savage NW, Mckay C, Faulkner C. Actinic Cheilitis in dental practice. Aust Dent J; Jun 2010 v.1, n1 p78-84.
6. Cavalcante AS, Anbinder AL; Carvalho YR. Actinic Cheilitis: clinical and histological fectures. J Oral Maxillofac Surg Mar 2008; 66(3): 488-503.
7. Czerninski R; Zini A; Sgan-Cohen HD. Lip cancer: incidence, trends, histology and survival: 1970-2006. Br J Dermatol; , 2010 May 162(5):1103-9.
8. Mitsuishi T, Ohara K, Kawashima M, Kobayashi S, Kawana S. Prevalence of human papillomavirus DNA sequences in verrucous carcinoma of the lip: genomic and therapeutic approoaches. Cancer Lett. 2005;26;222(2):139-43.
9. Silva CEXSR, Silva IDCG, Cerri A, Weckx LL. Prevalence of human papillomavírus in squamous cell carcinoma of tongue.Oral Medicine, Oral Pathology, Oral Radiology and Endodontics. October 2007; vol104(4) p 497-500
10. Lin K, Roosinovich E, Ma B, CF Hug, TC Wu. Therapeutic HPV DNA vaccines. Immunol Res 2010 Jul.47(1-3):86-112
11. Nielsen H, Norrild B, Vedofte P. Human Papilomavirus in oral premalignant lesions. Eur J Cancer oral oncol. 1996;(32) 267-70.
12. Miller CS, Johnstone BM. Human papillomavirus as a risk factor for oral squamous cell carcinoma: A meta-analysis 1982-1997. Oral surg oral med oral pathol oral radiol endod, 2001 91(6), 622-35.
13. Jimenez C, Correnti M, Salma N, Cavazza ME, Perrone M. Detection of human papillomavirus DNA in benign oral squamous epthelial lesions in Venezuela.J Oral Pathol Med 2001;30(7)385-8.
14. Summersgill KF, Smith EM, Kirchner HL, Haugen TH, Turek LP. P 53 polymorphism, human papillomavirus infection in the oral cavity and oral cancer. Oral surg oral med oral pathol oral radiol endod, 2000;90(3) 334-9.
15. Ibieta BR, Lizano M, Frans-Mendivil M, Barrera JL, Carrillo A, Ma Ruz-Godoy L, Mohar A. Human papillomavirus in oral squamous cell carcinoma in a Mexican population. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 99. 2005;(3):311-5.
16. Makoto K, Favre M, Obalek S, Jablonska S. Orth G. Premalignant lesions and câncer of the skin in the general population: evaluation of the role of human papillomavirusesJ Invest Dermatol 1990; 95(5):537-42.
17. Ostwald C, Rutsatz K, Scheweder J, Schmidt W, Gundlach K, Barten M. Human papillomavirus 6 / 11, 16 and 18 in oral carcinomas and benign oral lesions. Med Microbiol Immunol (Berl). 2003;192(3):145-8.
18. Van Der Waal, Diagnostic and therapeutic problems of oral precancerous lesions. Int. J. Oral Maxillofac. Surg. 1986;15:790-8.
19. Lewis BE, Pfeiffer BD, Mathog D, Celniker SE. Current Biology 2003; 13(15):587-8.
20. Aguiar SM. Contribuição ao estudo da queilite actínica: correlação anatomo-clínica 2006. 132f. Tese (Doutorado em Dermatologia) – Faculdade de Medicina da Universidade de São Paulo. São Paulo.
21. Wheeler CM. Natural history of human papillomavirus infections cytologic and histologic abnormalities and cáncer. Obstet Gynecol Clin North Am. Dec 2008;35(4):519-36
Bisphosphonate-induced Osteonecrosis of the Jaws, Main Aspects, Diagnosis and Treatment Protocol, Literature Review and Case Report
 Loading...
Loading...
Case Report: Keratosis palmoplantaris associated to periodontal disease (Papillon-Lefévre Syndrome)
Carlos Eduardo Xavier dos Santos Ribeiro da Silva *
Artur Cerri **
Francisco Octávio Teixeira Pacca ***
Ricardo Jahn ****
* Department of ENT/Head and Neck Surgery, UNIFESP, Sao Paulo, Brazil
Department of Oral Medicine, UNISA, Santo Amaro University, Sao Paulo, Brazil
** Department of Oral Medicine, Santo Amaro University, UNISA, Sao Paulo, Brazil
*** Department of Oral Medicine, Santo Amaro University, UNISA, Sao Paulo, Brazil
**** Department of Periodontology, Santo Amaro University, UNISA, Sao Paulo, Brazil
Send all correspondence to Dr. Carlos Eduardo X. S. Ribeiro da Silva, Rua Pelotas, 358 – Vila Mariana, 04012-001, Sao Paulo,SP, Brazil Voice /Fax : 55 11 5571-1736
Email adress: dreduardosilva@terra.com.br
Case Report: Keratosis palmoplantaris associated to periodontal disease (Papillon-Lefévre Syndrome)
ABSTRACT
This report describes a rare case of a 16 years old girl with keratosis palmoplantaris associated to periodontopathy or Papillon-Lefèvre syndrome. The patient went to Santo Amaro University – Dental College for dental treatment. This report presents the medical and stomatological progression, and suggest how to treat this condition. This syndrome requires a multidisciplinary team for treatment and control and the prognosis is still poor.
KEYWORDS
Papillon-Lefèvre Disease – Hyperkeratosis palmoplantaris – periodontal disease
INTRODUCTION AND LITERATURE REVIEW
The Papillon-Lefèvre syndrome or keratosis palmoplantaris associated to periodontopathy was first described by Papillon-Lefèvre, in 1924. It is an autosomal recessive genetic disease, with alteration in the gene CTSC, located in chromosome 11q14.1-q14.4, more precisely in the protein called cathepsin C (Hart et al., 2000; Shafer et al., 1987; Neville et al., 2001; Tommasi, 2002; Allende & Moreno, 2003; Hewitt et al., 2004; Selvaraju et al., 2003 )
It affects children and young adults of both sexes with no distinction. It is a very rare disease, with a prevalence of one in one million individuals. Its main oral clinical characteristics include periodontopathies, premature loss of deciduous teeth, at the age of 4-5 years and of the permanent teeth at approximately 14 years (Allegra & Gennari, 2000; Regezi & Sciubba, 2000; Tommasi, 2002; Siragusa et al., 2000). According to Shafer et al. (1987), only the permanent dentition is affected in some cases.
Patients also present halitosis, intense destruction of alveolar bone, and, in some cases, calcification of cortical bone, pathological tooth mobility and migration, reddish gingiva, with deep periodontal pockets (Tommasi, 2002; Fermin & Carranza, 1986; Allegra & Gennari, 2000; Neville et al., 2001).
Other signs of this syndrome are fragile nails, hypotrichosis, thin and scarce hair, generalized hypohydrosis, hyperkeratosis palmoplantaris, skin scaling, dry skin with a “dirty” appearance, painful deep fissures that worsen during winter, frontal bossing and occasional intracranial calcifications (Fermin & Carranza, 1986; Neville et al., 2001; Shafer et al., 1987; Tommasi, 2002).
Some authors also reported other findings, such as microphtalmus, intracranial calcification, arachnodactyly, osteoporosis, abnormal hepatic function, renal abnormalities and mental retardation (Shafer et al., 1987; Mahajan et al., 2003)
In some countries of the world the diagnosis is practically based on clinical aspects because there are no genetic tests available to confirm the presumptive diagnosis.
The most important oral manifestation is reabsorption of alveolar bone with consequent tooth loss, with no calculus and/or periodontal inflammatory processes to justify this. The possible immunological alterations involved are impaired chemotaxis of neutrophils and, possibly an induced immunological defect caused by an interaction of periodontal pathogens and pocket epithelium (Regezi & Sciuba, 2000; Neville et al., 2001; Ghaffer et al.,1999).
Microscopically, there are alterations characterized by marked chronic inflammation of the lateral wall of the pocket, with intense osteoclastic activity and apparent absence of osteoblastic activity (Fermin & Carranza,1986). Bacterial studies of plaque in a case of Papillon-Lefèvre syndrome showed a flora similar to that of periodontitis and not of periodontosis, and was composed basically of Porphyromonas gingivalis, Prevotella intermedia and Actinomyces actinomycetemcomitans (Fermin & Carranza 1986; Neville et al., 2001; Robertson, 2001).
Treatment is based on preventive and therapeutical periodontal procedures comprising intense oral hygiene, followed by appropriate orientation, periodontal treatment and referral to dermatologists to treat skin lesions (Tommasi, 2002; Allegra & Gennari, 2000;). According to Tommasi, 2002 and Shafer et al., 1987, it is clear that adequate nutrition and elimination of any eventual systemic factor are essential for disease prognosis. (Mahajan et al., 2993 )
Dental splinting may contribute to longer maintenance. Regezi & Sciubba, 2000, explained that submersion of healthy roots, could stabilize height and alveolar bone conformation and improve prognosis. Other authors presented different protocols, such as extraction of deciduous teeth, followed by antibiotic therapy during and after permanent tooth eruption. Another management would include continuous and combined use of mechanic control of plaque and systemic therapy (specific antibiotic), which could change the course of disease (Neville et al., 2001; Pratchyapruit & Kullavanjaya, 2002).
However, all authors mentioned that treatment is problematic, there are many failures and dental prognosis is very poor (Allegra & Gennari, 2000; Neville et al., 2001; Shafer et al., 1987; ).
CASE REPORT
The authors report the case of a 16 years old black girl, came to Santo Amaro University – Oral Medicine Service complaining of “tooth softening”, and no report of pain at all.
The patient reported good general conditions and no use of systemic medicines, and her mother confirmed this status. On regional extra-oral clinical examination, a prominent frontal bossing was observed, as well as scarce and thin hair in the frontal region. Her face was symmetrical with dolichocephalic shape.
On intra-oral examination, teeth presented large root exposures, moderate to intense mobility, migration but there was no salivary calculus or intense gingival inflammation that could justify such bone losses and mobility (Figure 1). Investigating the family history, including a younger brother, nothing important was reported.
The panoramic and periapical radiographic examinations enabled visualizing great vertical and horizontal bone reabsorption in the maxilla and mandible, predominantly in the molar region (Figures 2 and 3). Other complementary tests were ordered including alkaline phosphatase, complete blood count, glycemia, calcium, phosphorus, skull X-ray (posteroanterior and lateral), femur X-ray, GOT, GPT, urea and creatinine, looking for signs of bone, inflammatory, fibrous or hormone diseases. All results were within normal standards for age and sex of patient.
Therefore, we decided to perform an incisional biopsy of gingival attachment, in the region of the lower left molars and lower incisors. The pathologist report was unspecific chronic recurrent inflammatory process. Therefore, no etiologic or neoplastic agent was demonstrated. The histological analysis was inconclusive but helped ruling out many common diseases in the oral cavity.
On the general physical examination, the patient presented frontal bossing, hypotrichosis, dry skin with fissures and hyperkeratosis palmoplantaris (Figure 4). Based on clinical and laboratory characteristics made a presumptive diagnosis of Papillon-Lefèvre syndrome.
The oral treatment proposed was scaling and root and crown planing of both dental arches, splint fixation of some teeth, encouragement for and orientation about oral hygiene, and referral to a dermatologist to evaluate skin abnormalities. There was a significant improvement in tooth mobility and gingival inflammation. The patient has been constantly followed-up considering the poor oral health prognosis in this syndrome.
Discussion
The diagnosis of Papillon-Lefèvre syndrome was made primarily based on the clinical aspects of the patient, that is, major alveolar bone destruction with fast progression and little dental calculus, besides skin involvement and analysis of laboratory tests. The molecular test specific for Papillon–Lefèvre syndrome is not available in Brazil.
The differential diagnosis of Papillon-Lefèvre syndrome includes other bone diseases and, particularly, hypophosphatemia. This is based on reports by Tommasi (2002), who stated both conditions are carried by a dominant autosomal gene, and their differentiation would lay in the fact that hypophosphatemia presents more severe general and skeletal manifestations. Fermin & Carranza, in 1986, reported that Meleda disease differs from Papillon-Lefèvre syndrome for presenting hyperkeratosis of fingers and palms and no periodontitis (Ullbro et al, 2003).
Management consists of strict scaling and root and crown planing of all dental elements, encouraging and orienting patients to perform an adequate oral hygiene, as well as splinting of affected teeth to provide better oral health conditions. Systemic treatment should be prescribed by physicians.
CONCLUSIONS
Participation of a multidisciplinary team is crucial for treating and following-up patients affected with Papillon-Lefèvre syndrome. Dentists play an important role in diagnosis considering it is a disease with severe oral manifestations;
When making diagnosis, the clinical examination should be detailed, ordered and complete. A meticulous clinical examination is the basis for a reliable diagnosis;
Diagnosis of oral diseases very often depends on knowledge and choice of relevant laboratory tests that may confirm or rule out diseases with similar clinical picture and progression.
REFERENCES
Allegra, F; Gennari, P.U. As doenças da mucosa bucal. 1a ed. Santos livraria editora: São Paulo, 2000.
Allende LM; Moreno A; de Unamuno P A genetic study of cathepsin C gene in two families with Papillon-Lefèvre syndrome. Mol Genet Metab; 79(2):146-8, 2003 Jun.
Fermin, A; Carranza, JR; Dr. Odont. Periodontia clínica de Glickman. 5a ed. Editora Guanabara S.A.: Rio de Janeiro, 1986.
Ghaffer KA; Zahran FM; Fahmy HM; Brown RS. Papillon-Lefèvre syndrome: neutrophil function in 15 cases from 4 families in Egypt. Oral Surg Oral Med Oral Pathol Oral Radiol Endod; 88(3):320-5, 1999 Sep.
Hart PS; Zhang Y; Firatli E; Uygur C; Lotfazar M; Michalec MD; Marks JJ; Lu X; Coates BJ; Seow WK; Marshall R; Williams D; Reed JB; Wright JT; Hart TC Identification of cathenpsin C mutations in ethnically diverse Papillon-Lefèvre syndrome patients. J Med Genet; 37(12):927-32, 2000 Dec.
Hewitt C; McCormick D; Linden G; Turk D; Stern I; Wallace I; Southern L; Zhang L; Howard R; Bullon P; Wong M; Widmer R; Gaffar KA; Awawdeh L; Briggs J; Yaghmai R; Jabs EW; Hoeger P; Bleck O; Rüdiger SG; Petersilka G; Battino M; Brett P; Hattab F; Al-Hamed M; Sloan P; Toomes C; Dixon M; James J; Read AP; Thakker N The role of cathepsin C in Papillon-Lefèvre syndrome, prepubertal periodontitis, and aggressive periodontitis. Hum Mutat; 23(3):222-8, 2004 Mar.
Mahajan VK; Thakur NS; Sharma NL Papillon-Lefèvre syndrome. Indian Pediatr; 40(12):1197-200, 2003 Dec
Neville, B.W; Damm, D.D; White, D.K. Atlas colorido de patologia oral clínica. 2nd ed. Guanabara Koogan S.A.: Rio de Janeiro, 2001.
Pratchyapruit WO; Kullavanijaya P. Papillon-Lefèvre syndrome: a case report. J Dermatol; 29(6):329-35, 2002 Jun.
Regezi, JA, Sciubba, JJ. Patologia Bucal. Correlações Clinicopatológicas. 3a. Ed. Guanabara Koogan Rio de Janeiro, 2002
Robertson KT A microbiological study of Papallon-Lefèvre syndrome in two patients. J Clin Pathol; 54(5):371-6, 2001 May.
LEGENDS OF FIGURES
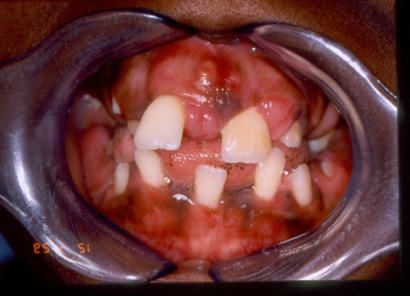
FIGURE 1 – Tooth migration
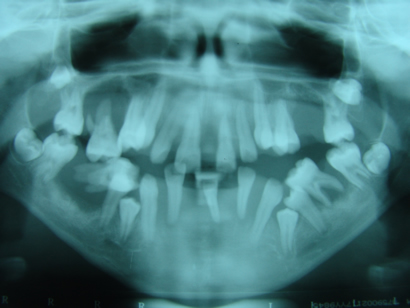
FIGURE 2 – Panoramic X-ray with extensive bone reabsorption
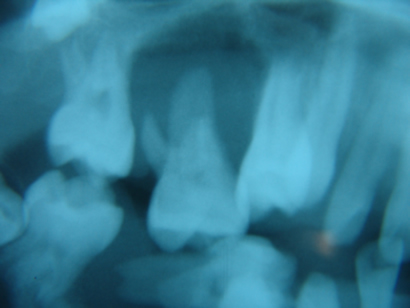
FIGURE 3 – Periapical X-ray – “floating tooth”
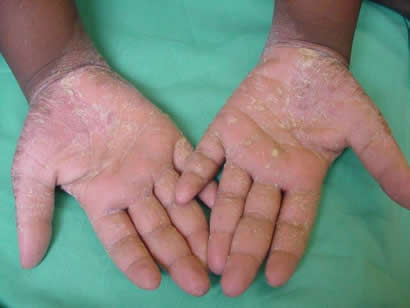
FIGURE 4 – Hyperqueratosis
Cevimelina: nova proposta terapêutica no tratamento da xerostomia
* Prof. Dr. Carlos Eduardo Xavier dos Santos Ribeiro da Silva
** Prof. Dr. Artur Cerri
*** Prof. Dr. Francisco Octávio Teixeira Pacca
**** Prof. Dr. João Ferreira dos Santos Junior
DECRITORES: Xerostomia – Saliva – Terapia – Boca – Glândulas Salivares
RESUMO:
A xerostomia é uma alteração quantitativa e/ou qualitativa da saliva que causa a sensação de boca seca. Neste trabalho além de ser discutida sua etiologia, diagnóstico, alterações da cavidade bucal e tratamento da xerostomia, os autores apresentam revisão de literatura de uma droga recém aprovada pelo FDA denominada cevimelina. A cevimelina é um sialogogo que possui a capacidade de incrementar o fluxo salivar. Esta é apresentada como uma alternativa para o tratamento dos pacientes portadores desta condição que em muito piora a qualidade de vida dos pacientes.
REVISÃO DE LITERATURA
A saliva exerce um papel essencial na manutenção da saúde oral. Alterações na função e/ou quantidade salivar levam ao comprometimento dos tecidos da cavidade oral e suas funções, e tem um grande impacto na qualidade de vida do paciente. Reduções do fluxo salivar se manifestam mais comumente com sintomas de boca ressecada. Essa queixa subjetiva de boca seca é denominada de xerostomia, ao passo que alterações objetivas na quantidade de saliva, são referidas como hipossalivação¹.
Para alguns autores, a xerostomia seria caracterizada pela secura evidente das mucosas, enquanto que a hiposalivação seria a diminuição do fluxo salivar e conseqüentemente menores efeitos colaterais que a xerostomia10,11.
As estruturas anatômicas responsáveis pela produção e secreção da saliva são as glândulas salivares e estão divididas em dois grupos distintos. As glândulas salivares maiores ( paródita, sub-mandibular e sub-lingual ) e as menores, que estão dispersas por toda a cavidade bucal e podem ser classificadas funcionalmente pelo seu produto de secreção ( serosa, mucosa ou mista ). O volume de secreção salivar diário é de aproximadamente 1,5 litros por dia.
* Especialista e Mestre em Estomatologia
Doutor pelo Depto de ORL/CCP da UNIFESP
Prof. Dr. das Disciplinas de Estomatologia e Pacientes Especiais da UNISA
** Especialista, Mestre e Doutor em Estomatologia pela USP
Prof. Titular da Disciplina de Estomatologia da UNISA
*** Especialista, Mestre e Doutor em Estomatologia pela USP
Prof. Dr. da Disciplina de Estomatologia da UNISA
***** Especialista em Cirurgia Bucomaxilofacial
Mestre e Doutorando pelo Depto de ORL/CCP da UNIFESP
Prof. Dr. da Disciplina de Pacientes Especiais da UNISA
A produção da saliva e o seu fluxo são modulados pelo sistema nervoso autônomo, por meio da ação do neurotransmissor acetilcolina ( parassimpático )13.
No que diz respeito a sua composição, a saliva é formada basicamente por água, eletrólitos, peptídeos, glicoproteínas, lipídeos, lisozimas, lactoferrina, imunoglobulinas, histamina, leucócitos fagocitários, fluoretos e mucina.
Dentre as múltiplas funções da saliva, destacam-se a proteção antibacteriana da cavidade bucal e do epitélio gastrointestinal, lubrificação das mucosas, auxílio na formação e deglutição do bolo alimentar, manutenção do equilíbrio ácido-básico ( ph ), retenção de próteses totais, função digestiva , auxílio na fonação e percepção do paladar.
Como pode ser notada, a função normal da saliva é importante para muitos aspectos da saúde oral. Adicionalmente, a saúde geral pode ser prejudicada quando a função salivar está afetada¹.
Existem numerosas causas de xerostomia, sendo o mais comum o uso de medicamentos. São mais de 500 drogas associadas com sintomas de boca seca¹, destacando-se os antidepressivos, anti-hipertensivos, anticolinérgicos, anti-histamínicos, diuréticos, antiinflamatórios, antineoplásicos, ansiolíticos, analgésicos, antipsicóticos, relaxantes musculares, anticonvulsivos e outras. Nos Estados Unidos, dos 200 medicamentos mais prescritos pela classe médica em 1999, 63% apresentavam potencial para causar xerostomia13.
A radioterapia que inclui as glândulas salivares no seu campo de tratamento, leva a uma profunda e permanente perda da função secretora¹,5,12,14.
Emoções4,12 ( como o estresse, depressão e ansiedade ) e certas doenças sistêmicas, como a doença de Parkison7,12, hepatite C6, hipotireoidismo¹,4, HIV¹,5,14, doença de Mikulicz³, síndrome de Sjogren¹,³,5,7,12,14 , doenças neurológicas5, tumores7 e diabetes¹,5,8 podem levar o paciente a apresentar boca seca, além de infecções de origem viral e bacteriana¹,7,8, menopausa5, anorexia8, respiração bucal14, bulimia8, alcoolismo8,, fumo14 e hipovitaminose A³ e a idade14.
Alterações eletrolíticas do organismo, como vômitos7, diarréia7, sede7 e hemorragias7, são causadoras de ressecamento bucal leve, que também se ocorre em pacientes portadores de respiração bucal³.
A redução do fluxo salivar apresenta um aumento de incidência três vezes maior no idoso do que no indivíduo adulto. Essa sintomatologia pode estar relacionada a algumas doenças sistêmicas ou a medicamentos usados no seu tratamento²,7. Mulheres são mais comumente afetadas do que os homens14.
Como consequências causadas pela xerostomia temos o aumento do índice de cáries ( particularmente envolvendo o terço cervical ou as bordas das cúspides ), doenças periodontais e candidíses, dificuldades de fonação e deglutição, diminuição na retenção de próteses totais, sensação de queimação na boca, alterações na sensibilidade gustativa, halitose, mucosas desidratadas e susceptíveis a traumas, fissuras na mucosa bucal, disfagia ( dificuldade de deglutição ), disfasia ( dificuldade em ordenar palavras ), disgeusia ( erro na percepção das sensações gustativas ), “ problemas digestivos ”, aumento da saburra no dorso lingual e ressecamento labial.
O diagnóstico de um paciente portador de xerostomia contém um princípio básico, focado em uma anamnese detalhada, investigando a fundo os fatores causadores da xerostomia, de preferência com uma série de perguntas específicas para pacientes com suspeita de boca seca. Apesar de a xerostomia sintomática não ser suficiente para o diagnóstico da disfunção salivar, algumas perguntas são úteis para identificar indivíduos que podem apresentar fluxo salivar diminuído: ressecamento na boca ao comer, necessidade de ingerir líquidos para a deglutição de alimentos secos, dificuldade para engolir e sensação de que há pouca saliva na boca9. O exame físico pode detectar mucosas ressecadas, língua fissurada e avermelhada, viscosidade salivar, doenças fúngicas, cáries e alterações de consistência das glândulas salivares. Saliva acumulada normalmente no assoalho da boca não será vista9. Exames como coleta de saliva ( sialometria ), ressonância magnética, sialografia e biópsia de glândulas salivar podem ser solicitados, além de exames específicos quando a suspeita de Síndrome de Sjogren.
O tratamento da xerostomia consiste na eliminação de suas causas, desde que seja possível e no uso de substâncias que confiram ao paciente conforto e alívio dos sintomas, que apenas podem ser controlados.
Em pacientes com ressecamento bucal leve, pode ser indicada ingestão de líquido várias vezes ao dia, além mascar de chicletes sem açúcar e cubos de maçã com gotas de limão, para alívio da sintomatologia. Deve-se evitar alimentos ácidos e condimentados, umidificadores de ambiente, ar condicionado ou aquecedores e substâncias alcalóides como a cafeína. O uso de hidratantes labiais é essencial. Em casos mais severos, o uso de substâncias químicas que aumentam o fluxo salivar, como o Cloridrato de Pilocarpina a 2% pingado sobre a língua ou ingerido em cápsulas de 5 mg podem ser efetivos para alguns pacientes. O Salivan® ( carmelose sódica ) e o Oral Balance®, que são substituidores de saliva, também podem ser utilizados.
Recentemente, um novo sialogogo, o hidrocloreto de cevimelina, foi aprovado pelo FDA ( Food and Drug Administration – USA)15 para alívio dos sintomas de boca seca em pacientes com Síndrome de Sjogren¹. A cevimelina é um anti-colinérgico que se liga a receptores muscarínicos. Os agonistas muscarínicos em doses sufucientes podem aumentar a secreção de glândulas exócrinas como as salivares e sudoríparas. A cevimelina é rapidamente absorvida possuindo um pico de concentração que varia de uma hora e meia a duas horas. Quando administrada junto com alimentos ocorre uma redução da sua absorção, com decréscimo de aproximadamente 17,3% de sua dose. A dose recomendada de cevimelina é de 30mg, três vezes ao dia. Ainda não existe informação suficiente para permitir o uso de doses acima de 90mg/dia. Os principais efeitos colaterais da cevimelina são caracterizados por sintomas parassimpáticos15. Esses incluem dor de cabeça, lacrimejamento, sudorese, náuseas, vômitos, diarréia e tremores. Os pacientes devem ser informados que a cevimelina pode causar distúrbios visuais, especialmente à noite, onde podem ser impedidos de dirigir com segurança. Outra recomendação necessária é que em pacientes com transpiração excessiva quando do uso de cevimelina devem consumir maior quantidade de líquido para prevenir a desidratação. Suas principais indicações estão embasadas nos quadros de redução do fluxo salivar, como em pacientes idosos, portadores da Síndrome de Sjogren e pacientes submetidos à radioterapia na região de cabeça e pescoço. Nos pacientes portadores de doenças cardiovasculares como história de infarto do miocárdio e angina pectoris, o uso da cevimelina deve ser feito sob acompanhamento cuidadoso15.
Instruções de higiene oral e dieta alimentar, evitando alimentos maciços, condimentados ou ácidos, bebidas alcoólicas e carbonadas, assim como o tabaco. Como os quadros de xerostomia podem contribuir para acréscimo do índice de cáries, é indicada aplicação tópica de flúor e/ou recomendações para o uso diário de soluções de fluoreto de sódio a 0,05%, bem como o uso diário de soluções de gluconato de clorexidina a 0,012%12.
CONCLUSÃO
A Cevimelina parece ser uma droga promissora para o melhora da qualidade de vida dos pacientes portadores de xerostomia.
Por tratar-se de um medicamento com pouco tempo de utilização clínica, requer ainda maiores estudos para se determinar com segurança à dose terapêutica, bem como seus efeitos colaterais.
REFERÊNCIAS BIBLIOGRÁFICAS
1-SILVERMAN S. J., EVERSOLE L. R, TRUELOVE E. L. Fundamentos de Medicina Oral. Editora Guanabara Koogan, 2004.
2- LOESCHE W. J. et al. Xerostomia, xerogenic medications ans food avoidances in selectes geriatric groups. J Am Geriatric Soc, v. 43, n.04, p. 401-447, Apr. 1995.
3- DAWES C. Physiological factors affecting salivary flow rate, oral clearance and the sensation of dry mounth in man. J Dent Res, v.66, Spec. No, p.648-653, Feb. 1987.
4- ASTOR F. C. et al. Xerostomia: a prevalent condition I the elderly. Ear Nose Throat, v.78, n.7, p. 476-467, July 1999.
5- ESCALONA L. A., ACEVEDO A. M. Xerostomia: diagnostico y tratamiento. Acta Odontol Venez, v. 28, n.1, p.37-40, ene 1990.
6- TORRES S. R., et al. Relação entre fluxo salivar e contagem de Cândida na saliva. Pesquisa Odontologia bRasileira, v.14, suppl., p. 138, set 2000.
7- ETTINGER R. L. Review: xerostomia: a symptom which acts like a disease. Age Ageing, v. 25, n.5, p. 409-412, Sept. 1996.
8- NAVAZESH M. et al. Salivary gland disease in human immunodeficiency virus-positive women from the WHIS study. Woman´s Interagency HIV Study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v. 98, n.6, p. 702-709, June 2000.
9- FOX P. C. Differentiaton of dry mounth etiology. Adv Dent Res, v.10, n. 1, p. 13-16, Apr. 1996.
10-MONN F., GUTTENBERGER R. Treatment of Xerostomia tollowing radiotherapy: doses age matter? Support Care Cancer, v. 10 (6), p. 5005-8, Sep. 2002.
11- BRENNAN M. T., et al. Treatment of Xerostomia: a systematic review of therapeutic trials. Dent Clin North Am. V. 46, n. 4, p. 847-56, Oct 2002.
12- COELHO C. M. P., et al. Implicações clínicas da xerostomia: Abordagens sobre o diagnóstico e tratamento. Rev APCD. V. 56, n. 4, p. 295-289. Jul/Ago 2002.
13- WYNN R. L., MEILLER T. F. Drugs and dry mounth. Gen Dent, v. 49, n. 1, p. 10-123, Jan/Fev 2001.
14- NEVILLE D. D. S. et al. Patologia Oral e Maxilofacial. Editora Guanabara Koogan, 1998.
15- www.fda.gov ; Acesso em Maio de 2008
Endereço Institucional dos autores:
Universidade de Santo Amaro – UNISA
Rua Enéas de Siqueira Neto, 340 – Jd. Das Imbuias
São Paulo – SP
Endereço de todos os autores para correspondência:
Rua Pelotas, 358 – Vila Mariana – São Paulo – SP – CEP 04012-001
dreduardosilva@terra.com.br
Declaração de Responsabilidade
Certifico que participei da concepção do trabalho para tornar pública minha responsabilidade pelo seu conteúdo, não omitindo quaisquer ligações ou acordos de financiamento entre os autores e companhias que possam ter interesse na publicação deste artigo;
Certifico que o manuscrito é original e que o trabalho, em parte ou na íntegra, ou qualquer outro trabalho com conteúdo substancialmente similar, de minha autoria, não foi enviado a outra Revista e não o será, enquanto sua publicação estiver sendo considerada pela RGO, quer seja no formato impresso ou no eletrônico.

Carlos Eduardo X. S. Ribeiro da Silva

Francisco Octávio Teixeira Pacca

Artur Cerri

João Ferreira dos Santos Junior
02/06/2008
Transferência de Direitos Autorais
Declaro que, em caso de aceitação do artigo, a RGO – Revista Gaúcha de Odontologia passa a ter os direitos autorais a ele referentes, que se tornarão propriedade exclusiva da Revista, vedado a qualquer reprodução, total ou parcial, em qualquer outra parte ou meio de divulgação, impressa ou eletrônica, sem que a prévia e necessária autorização seja solicitada e, se obtida, farei constar o competente agradecimento à Revista”.
Assinaturas do(s) autor(es) :

Carlos Eduardo X. S. Ribeiro da Silva

Francisco Octávio Teixeira Pacca

Artur Cerri

João Ferreira dos Santos Junior
02/06/2008
Contribuição de cada autor no trabalho
Sob a coordenação do Prof. Dr. Carlos Eduardo X. S. Ribeiro da Silva, os Professores Francisco Octávio Teixeira Pacca; Artur Cerri e João Ferreira dos Santos Junior realizaram a pesquisa bibliográfica correspondente ao assunto, traduzindo-a e interpretando-a.
Desvios de normalidade da cavidade bucal
PROF. DR. ARTUR CERRI
Especialista, Mestre e Doutor em Semiologia pela USP
Prof. Titular da Disciplina de Semiologia da UNISA, UCCB e UNG
Prof. Adjunto de Semiologia da UMC
PROF. CARLOS EDUARDO XAVIER DOS SANTOS RIBEIRO DA SILVA
Mestrando em Semiologia pela UCCB
Prof. Assistente da Disciplina de Semiologia da UCCB, UNISA e UNG
UNITERMOS
Alterações não patológicas – Variações anatômicas
SINOPSE
Os autores relatam algumas alterações bucais, que em função de seu aspecto clinico podem ser confundidas com patologias, apesar de serem apenas variações da normalidade.
SUMMARY
The authors describe some bucal alterations whose clinical aspects can be confounded with diseases, although be only variations of normality.
KEYWORDS
Alterations with no diseases – Anatomical variations
INTRODUÇÃO
A Odontologia nos dias atuais, está enquadrada na área de prevenção e diagnóstico das doenças da mucosa bucal, bem como dos ossos do complexo maxilo-mandibular, não cuidando somente das doenças que acometem os dentes (2,9,11).
Essa evolução no conceito da odontologia como ciência é evidenciada pela preocupação maior do cirurgião-dentista com a saúde bucal de seus pacientes, contribuindo para que eles atinjam perfeito estado de bem estar somato-psíquico-social (2,9,11).
O cirurgião-dentista moderno, como verdadeiro profissional da saúde, tem o dever e mais do que isto, a obrigação de conhecer detalhadamente as estruturas anatômicas da cavidade bucal, objetivando reconhecer e diagnosticar as diversas patologias quer de caráter local ou sistêmico que comprometem essa cavidade (2,9,11).
A elaboração do processo de diagnóstico de uma anormalidade deve estar alicerçada no binômio sinais e sintomas, não bastando apenas identificar uma anormalidade. Nesse particular, tem se afirmado que o diagnóstico é a capacidade do clínico de detectar ou notar a presença de uma alteração. A afirmativa dificilmente pode ser considerada como conceito básico, posto que subentende, por exemplo, que o diagnóstico é simplesmente a detecção de um sinal clínico como uma nodosidade, uma úlcera ou uma bolha (2,4,6,7,9,11). Na realidade, até um leigo é capaz de perceber a existência de anormalidade em presença de uma pessoa com face deformada. Em outras palavras, a simples constatação de uma alteração não revela conhecimento ou capacidade de identificar o processo patológico que a causou.
Como já se disse, o diagnóstico de uma anormalidade só pode ser realizado no conhecimento da sintomatologia apresentada. Além disso, como finalidade última do diagnóstico é sugerir e fornecer base correta para o plano de tratamento mais adequado, na realidade, torna-se pré-requisito necessário á terapêutica.
Muitas alterações carecem de sinais e sintomas esclarecedores, induzindo a erros na elaboração do diagnóstico e dedução do prognóstico, comprometendo até mesmo profissionais experientes. Muitas alterações ou anormalidades bucais não se traduzem necessariamente por doença, tratando-se muitas vezes de “desvio de normalidade” sem apresentar alterações patológicas significativas.
Inúmeros métodos e procedimentos podem ser utilizados na confecção de um diagnóstico correto, baseado apenas na observação clínica, sem recorrer a qualquer outro dado ou informação, sendo denominado de “diagnóstico clínico “. Em essência, o diagnóstico clínico é a identificação de uma anormalidade baseada apenas na observação e avaliação da entidade mórbida, através dos exames subjetivos e objetivos (2,4,5,6,7,8,9.11,12).
Neste trabalho, trataremos primordialmente das alterações mais comuns da cavidade bucal, não apresentando obrigatoriamente caráter de doença, tratando-se tão somente de “desvio de normalidade”. Essa condição, no entanto, não exime o profissional de efetuar um exame clínico detalhado e completo. Na maioria das vezes essas anormalidades são traduzidas pelo “diagnóstico clínico “, uma vez que os exames complementares são nesses casos, na maioria das vezes, inconclusivos, não orientando a natureza do processo.
LÍNGUA GEOGRÁFICA
Glossite migratória benigna, eritema benigno ou língua geográfica é uma alteração de etiologia desconhecida, embora acredita-se que possa estar relacionada ao stress ou distúrbios psicogênicos (1,3,5,6,7,8,10,12). Possui predileção por crianças e adultos jovens, sendo encontrada aproximadamente em 2% da população dos estados unidos, sendo ligeiramente mais frequente nas mulheres que nos homens (3).
Clinicamente apresente-se como múltiplas áreas planas avermelhadas com despapilação das papilas filiformes, formando figuras circinadas. São delimitadas por uma linha branca ou branca-amarelada de bordas bem definidas. Nas áreas de despapilação das papilas filiformes, permanecem como pequenas pápulas avermelhadas, as papilas fungiformes. Caracteristicamente ocorre uma repapilação das áreas despapiladas e uma despapilação de áreas anteriormente normais. Esse fenômeno de despapilação-repapilação dá um aspecto de “mapa” sendo por isso denominada de língua geográfica (3,5,6,7,8,9,11).
Usualmente a língua geográfica é uma condição assintomática. Em alguns casos, porém, os pacientes podem relatar irritação ou sensibilidade relacionados ao consumo de alimentos condimentados e bebidas alcoólicas. Uma alteração normalmente associada a língua geográfica é a língua fissurada e nesses casos a sintomatologia tende a ser mais evidente, graças a um excesso de crescimento de c. albicans nas fissuras. Devido a condição benigna e assintomática desta condição não é necessário tratamento. Nos casos onde haja sintomatologia dolorosa, a administração de anti-inflamatórios esteróides de uso tópico pode levar a uma melhoria do quadro. Embora tenha sido proposto, o tratamento com vitaminas do complexo B, não se mostrou eficaz quanto a sua atuação. No brasil estudos confiáveis dão conta que essa normalidade compromete 5% dos adultos jovens, não apresentando maior significado clínico (9) .
GLOSSITE ROMBÓIDE MEDIANA
Antigamente, considerava-se a glossite rombóide mediana como sendo uma anomalia congênita resultante da não fusão das metades laterais, antes que o tubérculo ímpar se interpusesse entre elas. Hoje acredita-se que sua etiologia esteja relacionada com uma infecção crônica causada pela c. albicans. Seu papel no aparecimento da lesão ainda não foi precisamente determinado. Segundo Gallina, 1968, não tem predileção por sexo ou raça, estando presente em aproximadamente 3,35% da população (3). É uma alteração que existe desde o nascimento, mas sua observação só pode ser feita com o crescimento da criança.
Clinicamente apresenta-se como uma zona avermelhada, despapilada, de forma rombóide ou oval, localizada na linha média do dorso lingual, imediatamente à frente das papilas valadas (1,3,4,5,6,8,10).
Frequentemente, forma uma massa composta por vários nódulos de limites irregulares, lisos e indolores. Deve ser considerado como diagnóstico diferencial o carcinoma espino celular de dorso de língua. Não existe tratamento para a glossite rombóide mediana a não ser a aplicação de anti-fúngicos, mesmo estes não tendo efetividade comprovada.
LÍNGUA FISSURADA
A língua fissurada é a alteração mais comum da língua e que segundo Gallina ( 1968 ) está presente em cerca de 5,92% da população (3). Não tem predileção por sexo e sua incidência parece aumentar com a idade. A irritação crônica e as deficiências vitamínicas são consideradas como possíveis fatores etiológicos, mas são necessários dados mais conclusivos. Aceita-se a etiologia da língua fissurada como sendo uma anomalia de desenvolvimento.
Manifesta-se clinicamente por um sulco central profundo no dorso, associado a numerosas fissuras secundárias que partem deste para as bordas da língua. O sulco central geralmente é mais profundo que os secundários que possuem simetria entre si.
Na maior parte dos casos é uma característica que passa sem ser notada pelo paciente, a não ser que inicia-se um processo de glossodinia e macroglossia com consequente edentação nas bordas ( 1,3,4,7,8,9,11.12).
É uma alteração usualmente indolor mas que pode apresentar sintomatologia graças ao acumulo de alimentos nos sulcos. Havendo a fermentação dos restos alimentares, instala-se um quadro de ardor e irritação, consequente à instalação do processo inflamatório.
Não existe tratamento especifico para a língua fissurada, mas deve se orientar o paciente a promover higienização através de escovação e bochechos.
LEUCOEDEMA
Até o momento ainda não foi estabelecida a causa ou etiologia do leucoedema, apesar de ser um achado clínico comum, em cerca de 70% da população negra (9). Parece ser uma anomalia de desenvolvimento, se bem que alguns autores relacionam essa anomalia com má higiene bucal e padrões anormais de mastigação. Leucoedema é usualmente um achado acidental. é assintomático , de distribuição simétrica e encontrado na mucosa jugal. apresenta-se como um área esbranquiçada ou leitosa . Nos casos mais acentuados pode-se notar uma alteração textural da superfície.
Um elemento clínico extremamente importante no diagnóstico do leucoedema é o fato de que ao se distender a mucosa jugal , a lesão desaparece, retornando quando deixamos de exercer a tração. O leucoedema não tem significado patológico, nem requer tratamento por ser inócuo.
Doenças como o nevo branco esponjoso, leucoplasia e líquen plano devem fazer parte das hipóteses diagnosticas tendo em vista sua semelhança com o leucoedema.
TOROS E EXOSTOSES
Os toros e exostoses são protuberâncias localizadas na superfície perióstica da maxila e mandíbula do osso adulto, cuja designação precisa depende da localização anatômica. embora, possa ocorrer na maxila e mandíbula em qualquer localização e idade, a maior prevalência é evidenciada na língua mediana do palato (20%), sendo que nessa região recebe o nome de toros palatinos (1,9). Esse tipo de toro predomina nas mulheres, normalmente antes da terceira década.
A segunda localização mais comum é na mandíbula (8%), onde há anormalidade se situa na face lingual da região de pré-molares e molares, sendo denominado nessa localização de toros mandibulares, afetando ambos os sexos igualmente (1,9).
Clinicamente os toros se caracterizam por massa óssea de crescimento lento e assintomático, revestido por mucosa normal. Os toros formam configurações variadas referidas como nodular, fusiforme, lobular ou achatada de tamanho variado (1,6,8,9,11). As exostoses são excrecências ósseas múltiplas que ocorrem menos comumente que os toros . São nódulos ósseos assintomáticos, que estão presentes ao longo da face vestibular do osso alveolar. essas alterações são notadas com maior frequência nas porções posteriores da maxila e mandíbula. Radiográficamente se apresentam como áreas radiopacas circunscritas ou difusas. A etiologia dessas anormalidades permanece obscura, embora tenham sido apresentadas evidencias sugerindo uma condição hereditária dos toros. Já nas exostoses, tem sido sugerido que esses crescimentos ósseos representam uma reação aumentada às forças oclusais dos dentes nas áreas envolvidas. Essas lesões são de pouco significado clinico . O tratamento dos toros e exostoses é desnecessário, a menos que seja exigido por questões protéticas ou tramas freqüentes à mucosa suprajacente.
PIGMENTAÇÃO RACIAL
Pigmentação racial , pigmentação melânica ou melanose racial são denominações de manchas de coloração escura localizada em área da mucosa bucal de indivíduos da raça negra (1,6,8,9,11). Apesar de serem extremamente comuns, alguns indivíduos não as apresentam . A maior prevalência da pigmentação racial é em áreas de gengiva inserida, seguida da mucosa jugal, palato e língua.
Em alguns casos, as lesões localizadas na mucosa jugal língua podem deixar dúvidas quanto ao diagnóstico e prognóstico, razão pela qual indica-se a realização de biópsia para exclusão de outras patologias.
Por se tratar de alteração benigna e sem maiores consequências , não requer tratamento. Nem tanto , quando a pigmentação for única, de bordas irregulares e ulcerada, devemos afastar a hipótese de melanoma.
GRÂNULOS DE FORDYCE
São glândulas sebáceas ectópicas, pois estes são anexos naturais da pele e não da mucosa bucal. Clinicamente aparecem como pequenas pápulas amareladas, pouco elevadas de diâmetro não superior à 2mm ( desde que não estejam coaptadas ). Usualmente encontram-se unidas formando conglomerados que localizam-se com mior frequência na mucosa jugal ( região posterior ) e na mucosa labial.
Há um aumento significativo da prevalência dos grânulos de fordyce com a idade. Não apresenta nenhum significado patológico e portanto não deve ser tratado. A importância do correto diagnóstico é o fato de poder-se orientar os pacientes quanto ao aspecto benigno desta alteração (1,6,8,9,11).
CONCLUSÕES
A análise e estudo das alterações bucais não patológicas, nos permitiu chegar a algumas conclusões a saber :
– O conhecimento profundo da anatomia bucal é de fundamental importância para a elaboração de um diagnóstico correto,
– O exame clinico detalhado e completo é fundamental na elaboração de hipótese diagnóstica confiável,
– O conhecimento de alterações comuns e inócuas da cavidade bucal é necessário para que o cirurgião-dentista tranquilize seus pacientes quanto ao seu prognóstico.
REFERÊNCIAS BIBLIOGRÁFICAS
- BHASKAR, S. N. PATOLOGIA BUCAL. 5.ED. SÃO PAULO, ARTES MÉDICAS, 1993.
- CERRI, A. ESTUDO EPIDEMIOLÓGICO DA PREVALÊNCIA DE POSSÍVEIS DOENÇAS PROFISSIONAIS EM CIRURGIÕES-DENTISTAS DO MUNICÍPIO DE SÃO PAULO. 63p. SÃO PAULO, 1991. TRABALHO DE DOUTORADO – FACULDADE DE ODONTOLOGIA DA USP.
- GALLINA, L. “ESTATÍSTICA SOBRE FREQUENCIA DE LÍNGUA ESCROTAL, LÍNGUA GEOGRÁFICA, LÍNGUA NEGRA PILOSA, GLOSSITE ROMBÓIDE MEDIANA, ANQUILOGLOSSIA EM 3274 ESTÔMATO-PACIENTES.” RESSEGNA INTERNAZIONALE DI STOMATOLOGIA PRÁTICA, 19 : 261-67, 1968.
- JANUTZ, E.; MELNIK, J. L.; ADEBURG, E. A. MICROBIOLOGIA MÉDICA. RIO DE JANEIRO, GUANABARA KOOGAN, 1982.
- LEVENE, G.M. & CALNAN, C.D. ATLAS DE DERMATOLOGIA. RIO DE JANEIRO, ATHENEU, 1978
- REGEZI & SCIUBBA PATOLOGIA BUCAL – CORRELAÇÕES CLINICO PATOLÓGICAS GUANABARA KOOGAN, RIO DE JANEIRO, 1991
- ROBBINS, S.L.; COTRAN, R.S.; ZUMAR, Y. PATOLOGIA ESTRUTURAL E FUNCIONAL. 3 ed. RIO DE JANEIRO, GUANABARA KOOGAN, 1984.
- SONIS, S.T.; FAZIO, R.C.; FANC, L. MEDICINA ORAL. RIO DE JANEIRO, INTERAMERICANA, 1985
- TOMMASI, A. F. DIAGNÓSTICO EM PATOLOGIA BUCAL. 2.ed. SÃO PAULO, PANCAST, 1989
- WOLOSKER, M. & MURACO, B. CLÍNICA MÉDICA 3.ed. RIO DE JANEIRO, GUANABARA KOOGAN, 1984
- ZEGARELLI, E.V.; KUTSCHER, A.H.; HYMAN, G.A. DIAGNÓSTICO DAS DOENÇAS DA BOCA E DOS MAXILARES. 2ed. RIO DE JANEIRO, GUANABARA KOOGAN, 1981
- ZWEMER, J.D. & WILLIANS, J.E. LOURNAL OF THE AMERICAN COLLEGE OF DENTISTS, 54 (4) : 07-13, 1987
Importância do acompanhamento seriado nos indivíduos portadores de líquen plano oral.
Autores:
- Cristina Nahas Martin
Médica do setor de otorrino-pediatria da UNIFESP - Andressa Rocha Camporez
Residente do terceiro ano de otorrinolaringologia da UNIFESP - Carlos Eduardo X. S. Ribeiro da Silva
Cirurgião Dentista estomatologista da UNIFESP / UNISA - Cleonice Hirata
Chefe do setor de estomatologia na UNIFESP - Luc Louis Weckx
Chefe do departamento de otorrino-pediatrica da UNIFESP - Artur Cerri
Titular de Estomatologia da UNISA
Autora: Cristina Nahas Martin
Rua Barão do Bananal 450/91
V. Pompéia, São Paulo- SP
Cep 05024-000
e-mail: crisnm99@hotmail.com
Importância do acompanhamento seriado nos indivíduos portadores de líquen plano oral
Relato de caso
I. Resumo
Nosso trabalho visa mostrar, através de um caso clínico, a importância do segmento bem feito de um portador de líquen plano oral na detecção precoce do carcinoma espinocelular na cavidade oral.
II. Descritores
Líquen plano oral
Potencial maligno
Carcinoma espinocelular
III. Introdução
O Líquen Plano é uma desordem relativamente comum entre as alterações mucocutâneas, com incidência igual ou maior que a psoríase.1 Líquen plano oral é uma inflamação crônica da mucosa oral sem causa conhecida, caracterizada por remissões e agudizações.2,7 Um terço dos pacientes com líquen cutâneo tem lesões orais.1 Afeta mais mulheres na proporção variando de 1,4:1 até 3:1.1,2,3 Predomina em idades superiores à 40 anos, mas pode afetar crianças e adolescentes também.
Pode se apresentar de três formas: reticular, eritematoso ou atrófico e bolhoso. O diagnóstico é feito com anamnese e exame físico, muitas vezes precisando fazer o exame histopatológico, tanto para o diagnóstico quanto para diferenciar de outras lesões brancas ou lesão ulcerada oral.1,2,7
A descrição clássica inclui hiperqueratose, degeneração da membrana basal e infiltrado constituído por linfócitos, na região sub-epitelial. Mas nem sempre os sinais clássicos estão presentes, neste momento podemos optar pela imunofluorescência que nos ajuda no diagnóstico.1,2,4,6,7 a imunofluorescência cora fibras e fibrinogênios na membrana basal.
O líquen plano é considerado uma lesão pré-maligna. Mas sua transformação maligna é controversa. Aproximadamente 0,2% dos liquens orais evoluem para carcinoma ao ano. Porém menos que 0,5% dos com líquen plano e não fumantes desenvolvem carcinogênese. É mais comum a transformação maligna em liquens erosivos ou atróficos. Aumenta o risco de transformação quando o portador de líquen é exposto a fatores mutagênicos, pois se torna mais sensível, eles são o tabaco, álcool, mascar fumo e candidíase.
IV. Relato do caso
MMN, 73 anos, sexo feminino, natural de Minas Gerais e procedente de São Paulo há 58 anos; veio ao nosso serviço queixando-se de aftas recorrentes há 3 anos em fevereiro de 1995. Após tratamento odontológico com confecção de próteses dentárias (prótese total superior e parcial inferior removível do lado direito), passou a apresentar lesões aftosas recorrentes em lateral direita da língua. Referia dor local após ingesta de alimentos ácidos, e negando etilismo e tabagismo.
Ao exame físico apresentava lesão branca, endurecida em bordo lateral direito de língua com aproximadamente 4,0 x 2,0 cm.
Foram levantadas as hipóteses diagnósticas de líquen plano e leucoplasia. Realizada biopsia incisional em bordo lateral direito obtivemos como resultado de líquen plano em fevereiro de 1995.
Na ocasião foi prescrito corticóide tópico (beclosol spray) no local com melhora importante da sintomatologia da paciente, e pedido retornos de 3 em 3 meses para proservação da lesão, fato este que foi seguido religiosamente, Estando relatado apenas um hiato nas consultas entre 1996 e 1998.
A paciente retornou em abril de 2003 onde foi observada uma lesão sobrelevada de 3,0 x 2,0 cm; Foi realizada exérese da mesma, sendo descrita no anatomo-patológico como processo inflamatório crônico com acantose, hiperqueratose e paraqueratose. Descrição esta compatível com líquen plano. Sendo assim foi mantida a conduta de corticóide tópico e retornos seriados para acompanhamento.
Em abril de 2005 retorna relatando crescimento da lesão durante os últimos 6 meses e dor local. Ao exame é observada lesão vegetante em borda direita de língua. Realizada biopsia incisional na consulta. O resultado do serviço de anatomia-patológica do Hospital São Paulo foi de estomatite liquenóide e glossite liquenóide. Mas como a suspeita clínica se mantinha como carcinoma espinocelular foi repetido em junho deste mesmo ano nova biópsia e mandado para dois lugares conceituados, sendo um deles o nosso serviço de patologia clínica e ambos tiveram como diagnóstico de carcinoma espinocelular bem diferenciado superficialmente invasivo.

Na descrição da lâmina nos mostra epitélio malpighiano com trecho em solução de continuidade onde há lesão de crescimento infiltrativo constituída por células epiteliais anaplásicas e em diferenciação espinocelular, estando dispostas em blocos sólidos, arranjos cordonais e estruturas concêntricas onde os citoplasmas se apresentam queratinizados (pérolas córneas). Os núcleos são pleomórficos e hipercromáticos, de cromatina grosseira irregularmente distribuída, tendo citoplasma eosinófilos e homogêneos. O estroma de linfócitos e plasmócitos, além de vasos congestos e edema.
A paciente foi encaminhada a Disciplina de Cirurgia de Cabeça e Pescoço da UNIFESP, onde foi realizada glossectomia parcial encontrando-se em acompanhamento.
VI. Conclusão
A associação de líquen plano e carcinoma espinocelular é controversa. Foram encontradas displasia associada ao líquen oral em 11 a 25%.2 A literatura propõe que se faça retornos seriados para acompanhamento das lesões a cada 4 meses e biopsias a cada 6 meses. Que se mantenha o indivíduo sempre sem ulcerações ou atrofias (tendo em vista que são as lesões mais correlacionadas com a transformação maligna), ou ainda sem candidíase que é comumente encontrada no diagnóstico e durante o tratamento com corticóides ou imunossupressores. A candidíase é um outro fator de risco para a carcinogênese, bem orientado quanto à associação de outros fatores de risco, como tabaco e álcool. Como sabemos se o diagnóstico é feito em T1 o tumor é curável. Não temos como evitar a transformação maligna, mas com cuidado constante temos como evitar maiores mutilações e maior chance de cura.
Importance of regress series in pacients with oral liquen planus
I. Abstrat
Our work aims at to show, through a clinical case, the importance of the segment made well of a carrier of verbal plain lichen in the precocious detention of the carcinoma to espinocelular in the verbal socket.
II. Descriptors
Oral liquen planus
Malignant potencial
Squamouus cell carcinoma
V. Bibliografia
Eisen, D. The clinical manifestations and treatment of liquen planus. Dermatologic Clinics. 2003; 21: 79-89
Epstein, JB, Wan, LS, Gorsky,M, Zhang, L. Oral liquen planus: progress in understanding its malignant potencial and implications for clinical management. Oral Surgery Oral Medicine Oral Pathology. 2003; 96 (1): 32-37
Fatahzadeh,M, Rinaggio,MS, Chiodo, T. Squamouus cell carcinoma arinsing in oral lichenoid lesion. Clinical Practice. 2004; 135:754-759
Gandolfo, S, Richiardi, L, Carrozo, M, Broccoletti, R, Carbone,M, Pagano, M. Risk of squamous cell carcinoma in 402 patients with oral liquen planus: a follow-up in an Italian population. Oral oncology. 2004; 40: 77-83
Mignogna, MD, Fedele,S, Russo, LL, Muzio, L, Bucci, E. Immune activation and chronic inflammation as the cause of malignancy in oral líquen planus: is there any evidence? Oral Oncology. 2004; 40: 120-130
Rödström, PO, Jontell,M, Mattsson, U, Holmberg, E. Cancer and oral liquen planus in Swedish population. Oral Oncology. 2004; 40:131-138
Surgerman, PB, Savage, NW. Oral líquen planus: causes, diagnosis and management. Australian Dental Journal. 2002; 47 (4): 290-297
Lesão Central de Células Gigantes: Relato de um caso clínico
Publicado na Revista da Associação Paulista de Cirurgiões Dentistas – APCD, Vol 66, nr 4, Dezembro de 2012
Authors:
Prof. Dr. Carlos Eduardo Xavier dos Santos Ribeiro da Silva.
Especialista e Mestre em Estomatologia Doutor pelo Departamento de Otorrino e Cirurgia de Cabeça e Pescoço de UNIFESP/ESPM Professor Titular da Disciplina de Semiologia da Universidade de Santo Amaro- UNISA
Adriana Hecht
Cirurgiã Dentista pela Faculdade de Odontologia da Universidade de Santo Amaro-UNISA
Fabio Pedraza da Silva
Cirurgião Dentista Faculdade de Odontologia da Universidade de Santo Amaro-UNISA Aluno do curso de Especialização em Implantodontia da Universidade Paulista de São Paulo
Prof. Dr. Francisco Octávio Teixeira Pacca
Especialista, Mestre e Doutor em Estomatologia pela USP
Prof. Dr. Artur Cerri
Especialista, Mestre e Doutor em Estomatologia pela USP Diretor da Escola de Aperfeiçoamento Profissional da APCD
Dr. André Carvalho Rodrigues
Especialista em Estomatologia e Imagenologia Odontológica Responsável pelo setor de Diagnóstico por Imagem da APCD
Dra. Daniela Marti Costa
Mestre pelo Depto de Imagenologia da Unifesp Professora das Disciplinas de Semiologia e Propedêutica Clinica da UNISA
Resumo:
A lesão central de células gigantes (LCCG) é própria dos ossos gnáticos, é um tumor benigno não odontogênico. É uma lesão de crescimento predominantemente lento, bem circunscrito e assintomático, sendo geralmente diagnosticado através de algum exame de rotina ou em casos mais avançados quando começa aparecer certo desconforto e também a afetar a estética. Este trabalho apresenta um caso clínico de lesão central de células gigantes em uma paciente do sexo feminino de 36 anos de idade com uma lesão na região de pré-molares inferior direita. Após avaliação radiográfica, da tomografia, exames sanguíneos e biópsia incisional, foi realizada a curetagem da lesão sob anestesia geral.
Relevância Clínica:
Mesmo que o profissional não trate lesões de boca, é importante o conhecimento de algumas lesões para não ser confundida com lesões periapicais, por exemplo, como no caso das lesões centrais de células gigantes e enviá-lo para correto tratamento.
Introdução:
De acordo com a Organização Mundial da Saúde (OMS) a Lesão Central de Células Gigantes, que também pode ser denominada Granuloma Central de Células Gigantes ou ainda como Tumor Central de Células Gigantes, é definida como uma lesão intra-óssea que consiste em tecido fibroso com focos múltiplos de hemorragia, agregação de células gigantes multinucleadas e, ocasionalmente trabéculas de tecido ósseo.
Essa lesão foi descrita pela primeira vez por Jaffe em 1953, porém ainda hoje há dúvidas e controvérsias no que diz respeito à terminologia e à classificação. Apesar de ter uma etiologia desconhecida, alguns autores dizem que esta lesão teria relação com a ocorrência de uma hemorragia intramedular devido a algum tipo de trauma; embora nem sempre se obtenha essa história de trauma local.
Jaffe chamou essa lesão de “granuloma reparador de células gigantes” por ser uma resposta do organismo há um trauma; denominação que foi questionada por Waldron e Shafer em 1966, devido a sua capacidade destrutiva e não reparadora; por esse motivo foi sugerido por eles a não utilização do termo “reparativo”, já que o comportamento clínico não era compatível com essa designação.
Ocorre predominantemente entre a segunda e terceira década de vida, o que não impede que encontremos esse tipo de lesão em outras faixas etárias também, sejam elas para mais ou para menos. Tem uma predileção pelo sexo feminino numa proporção de 2:1, e essa predileção tem sido relacionada a uma possível influência do estrógeno e da progesterona no desenvolvimento do granuloma. Com relação a sua localização, tem predileção pela mandíbula envolvendo com certa freqüência a região de pré-molares e molares, embora algumas vezes a lesão ultrapasse a linha média.
Essas lesões podem ser classificadas como agressivas ou não agressivas de acordo com sua manifestação clínica. As lesões agressivas possuem crescimento rápido, expansão de corticais, sensação dolorosa, alta taxa de recidiva, e em alguns casos reabsorção das raízes dos dentes envolvidos pela lesão. Já as lesões não agressivas caracterizam-se pelo crescimento lento, sem a expansão de corticais, é assimétrico, baixo índice de recidivas e não promove reabsorção radicular.
Os dentes podem sofrer migração, mas, apesar da tumefação indolor, a mucosa de revestimento se apresenta intacta e normal.
As corticais ósseas ficam adelgadas, mas a sua perfuração bem como a expansão para tecidos moles é pouco freqüente, desta forma o exame à palpação mostra uma área de expansão dura que apresenta certa flexibilidade.
Radiograficamente, apresentam-se como uma expansão radiolúcida, uni ou multilocular que geralmente é atravessada por espículas ósseas; sendo as bordas da lesão relatadas como bem definidas. A movimentação dentária, reabsorção radicular, expansão e perfuração da cortical óssea, também são possíveis achados radiográficos.
Microscopicamente, encontramos freqüentemente macrófagos carregados de hemossiderina, assim como eritrócitos extravasados. Células gigantes multinucleadas estão presentes ao longo do estroma de tecido conjuntivo fibroso frouxo intercalado com muitos fibroblastos em proliferação e freqüentemente agregados em redor dos vasos e pequenos capilares.
No diagnóstico diferencial da lesão central de células gigantes encontramos: amelobastoma, cisto ósseo aneurismático, displasia fibrosa, manifestações do hiperparatireoidismo, querubismo, ceratocisto odontogênico, mixoma, cisto ósseo traumático, lesões periapicais, cistos periapicais; sendo necessária a realização de exames complementares, tais como: tomografia computadorizada, biópsia incisional e exames bioquímicos dos valores séricos de cálcio, fosfatase alcalina e fósforo, para excluir ou não os indicativos de hiperparatireoidismo.
No tratamento destas lesões, geralmente é recomendado como tratamento de eleição ou curetagem agressiva dessa massa tumoral, algumas vezes removendo margens ósseas da periferia; que resulta num bom prognóstico e baixa taxa de recidiva. Porém o tratamento vai ser eleito de acordo com a gravidade de cada caso. Em casos menos agressivos, uma curetagem com remoção ou não dos dentes envolvidos é uma boa indicação; já em casos mais agressivos podemos chegar até uma ressecção em bloco, sendo ela parcial ou total, podendo ser acompanhado de uma reconstrução com enxerto autógeno de crista ilíaca. Em alguns casos a curetagem tem sido suplementada com a criocirurgia. Pode ocorrer também a necessidade de tratamento endodôntico pré ou pós cirúrgico.
Há também publicações que relatam bom resultado com injeções intralesionais de corticóides; que estimulariam a apoptose das células gigantes e a inibição da protease lisossômica, que estimularia a reabsorção óssea, porém esse tratamento é contra indicado em pacientes imunodeprimidos, com diabetes ou com infecções graves.
A radioterapia está contra indicada, pois existem evidências de transformação maligna como o sarcoma após o tratamento com radiação, ainda que em porcentagem mínima.
O prognóstico é bom desde que se tenha o diagnóstico em mãos para se traçar em plano de tratamento ideal para cada caso, porém podem ocorrer recidivas; a maior taxa de recidiva tem sido relatada em lesões que surgem em crianças e adolescentes jovens.
Relato de Caso:
Paciente leucoderma, 36 anos de idade, gênero feminino, chegou à clínica apresentando grande aumento de volume facial na região lateral direita da mandíbula. Relatou aparecimento indolor do edema e nos últimos meses sentia formigamentos esporádicos no lábio, que ia aumentando com o passar do tempo.
Ao exame clínico observou-se um edema intra-oral que se encontrava na região de molares e pré-molares inferiores na face vestibular. A gengiva e mucosa apesar de bem edemaciada apresentavam cor e textura normais. À palpação o edema era bem consistente, porém com alguma flexibilidade. Foi solicitada uma radiografia panorâmica que apresentava uma lesão bem circunscrita multiloculares; na radiografia periapical, confundia-se com uma lesão periapical. Foi solicitado também uma tomografia e exames de sangue.
Na tomografia foi observado que as extensões do tumor eram maiores do que se via nas radiografias, mostrando com clareza a grande massa tumoral e a grande fenestração óssea na face vestibular e uma pequena fenestração também na lingual.
Para que pudéssemos fechar ao certo o diagnóstico e traçar o melhor plano de tratamento para o caso, foi realizada uma biópsia incisional, tendo como diagnóstico final o granuloma central de células gigantes.
A paciente foi submetida a anestesia geral em centro cirúrgico hospitalar. Realizou-se ampla incisão intrassulcular vestibular de incisivo central inferior direito (com uma relaxante em sua mesial) até o segundo molar inferior direito. Com o deslocamento do retalho já houve a exposição da lesão, pois a taboa óssea vestibular já tinha sido destruída pela lesão. Executou-se, então, criteriosa curetagem removendo-se toda lesão, onde foi encontrada um pequena artéria dentro da lesão, a qual foi pinçada e cauterizada.
Foi optado por manter os dentes da paciente pela idade da mesma e pelo comprometimento estético significativo que acarretaria para a paciente, tanto em sua vida social quanto profissional. Após o término da remoção da lesão e curetagem criteriosa, foi reposicionada a taboa óssea basal restante e o retalho, e suturado com fio reabsorvível.
O pós-operatório transcorreu dentro dos aspectos de normalidade e sem nenhuma complicação.
Paciente encontra-se em acompanhamento clínico e radiográfico.
Foi solicitado também o tratamento endodôtico pós-operatório dos dentes 45 (segundo pré-molar inferior direito), 44 (primeiro pré-molar inferior direito), 43 (canino inferior direito) e 42 (incisivo lateral inferior direito), pois devido à grande extensão da lesão foi verificado que esses dentes após a cirurgia perderam sua vitalidade, após o teste realizado.
Em seis meses de pós-cirurgia não houve recidiva e houve o início de uma neofromação óssea na região.
Após um ano e meio a dois anos de proservação, será planejado um enxerto ósseo na região da lesão, se não houver recidivas.
Discussão:
O diagnóstico precoce é um fator muito importante no tratamento da lesão central de células gigantes, podendo assim prevenir a expansão da lesão e ao conseqüente aumento destruição óssea, evitando assim maior mutilação ao paciente após o tratamento.
O exame histopatológico e os novos recursos de imagenologia são condições obrigatórias para um planejamento cirúrgico sempre que suspeitar desse tipo de patologia, para que se possa avaliar o grau de envolvimento ósseo, nitidez a extensão da lesão para estruturas adjacentes, formação de trabéculas ósseas e expansão para tecidos moles.
Um demonstrativo de que há vasos e muita irrigação sanguínea na lesão é o fato de termos, nesse caso, encontrado uma arteríola na lesão, rompendo-se quando fazíamos a curetagem da lesão.
A escolha da terapia dependerá da idade do paciente e das características clínicas da lesão e do seu grau de agressividade.
A idade do paciente e o tamanho da lesão no tempo de tratamento inicial influenciam na freqüência da recidiva; sendo mais comum a recidiva em pacientes mais jovens.
Os aspectos básicos do granuloma central de células gigantes são importantes tornarem-se conhecidos, pois segundo um estudo feito por Grandi et al em 2005 no serviço de patologia bucal da PUCRS, das lesões ósseas diagnosticadas no departamento; as lesões ósseas mais freqüentes foram as lesões centrais de células gigantes. Podendo assim qualquer profissional de deparar com uma situação dessa, podendo fazer seu diagnóstico diferencial.
Conclusão:
Para que se obtenha sucesso no tratamento é indispensável o correto diagnóstico da patologia a ser tratada. Deve-se usar para isso, todos os recursos disponíveis como anamnese, exame clínico e exames complementares, desde uma radiografia periapical até uma tomografia computadorizada e exames histológicos e bioquímicos; levando-se em consideração a necessidade de um diagnóstico diferencial entre patologias que apresentem sintomatologias e comportamentos semelhantes.
O tipo de tratamento a ser escolhido deve se basear no comportamento clínico da lesão, localização da mesma e idade do paciente. Porém a curetagem ainda é o tratamento mais utilizado e com alta taxa de sucesso.












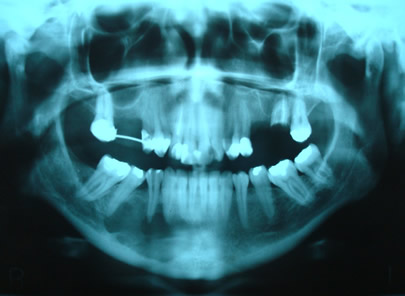
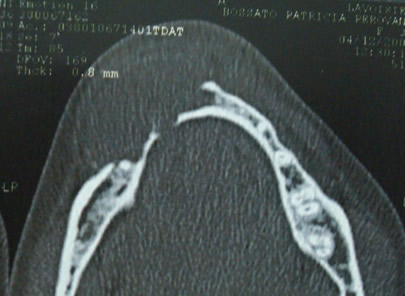
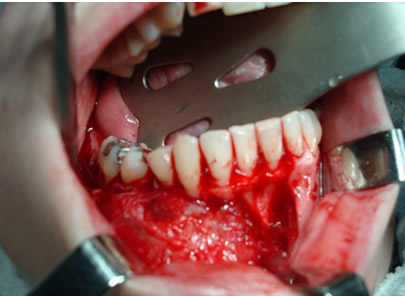
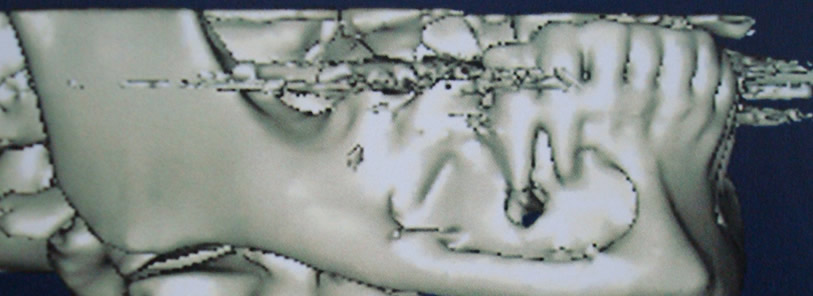
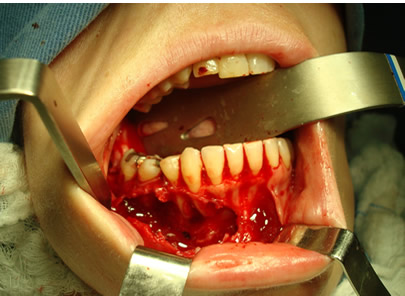
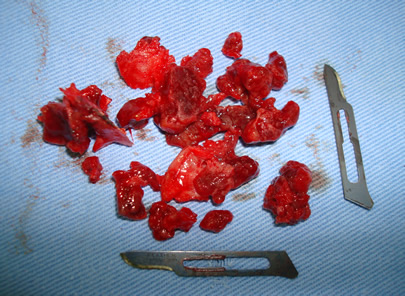
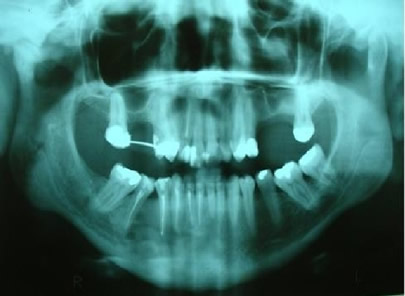
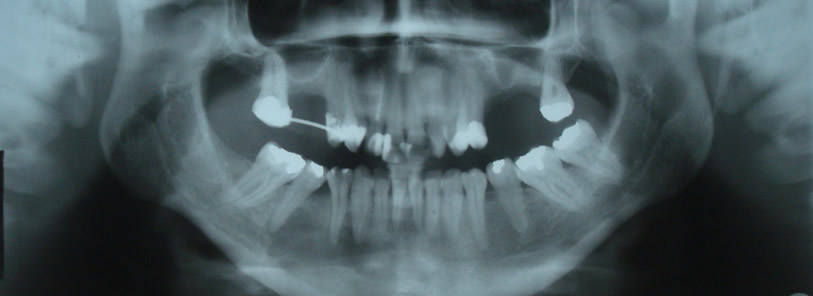
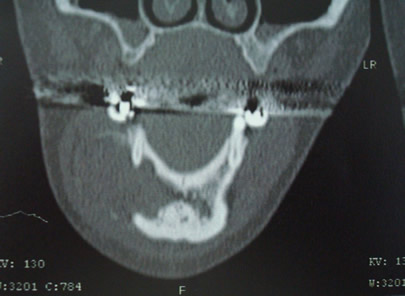
Língua geográfica: revisão de literatura
GEOGRAPHIC TONGUE: REVIEW OF THE LITERATURE
* Artur CERRI
** Carlos Eduardo Xavier dos Santos RIBEIRO DA SILVA
*** Francisco Octávio Teixeira PACCA
**** Patrícia SILVA
_______________________________________________________________________
* Especialista, Mestre e Doutor em Semiologia
Prof. Titular de Estomatologia da UnG, UNICASTELO E UNISA.
Prof. Adjunto de Semiologia da Faculdade de Odontologia da UMC.
** Especialista e Mestre em Estomatologia
Doutorando pela UNIFESP / EPM
Prof. Adjunto de Semiologia da UnG, UNICASTELO e UNISA
*** Prof. Titular de Semiologia da UNILUS
Prof. Adjunto de Semiologia da UnG, UNICASTELO E UNISA
**** Acadêmica do 3º ano de Odontologia da UnG
Membros da Sociedade Paulista de Estomatologia e Câncer Bucal – SOPE
RESUMO
Baseado na revisão da literatura os autores relatam os aspectos clínicos da língua geográfica, bem como sua prevalência em relação a idade e sexo, abordando também os possíveis tratamentos.
ABSTRACT
Based on the review of the literature, the authors report the clinical aspects of the geographic tongue and this relation with sex and age, discussing the possible treatments.
UNITERMOS
Língua Geográfica – Doenças da Língua – Glossite Migratória Benigna
KEYWORDS
Geographic Tongue – Tongue Diseases – Benign Migratory Glossitis
INTRODUÇÃO
Também conhecida por eritema migratório e glossite migratória benigna, a língua geográfica (Fig. 1.), é uma condição de etiologia ainda obscura e de aspecto clínico multiforme.
Apesar de ter sido considerada por alguns autores como uma anomalia de desenvolvimento, CHERASKIN & LANGLEY (1984) ,verificaram que é observada principalmente em crianças, sobretudo nas portadoras de alterações emocionais. Por esse motivo vem sendo considerada por muitos, como sendo de origem psicogênica . No entanto, alguns autores atribuem uma possível causa alérgica a sua etiologia. Tem se observado que um grande número de casos ocorre na primeira infância e tendem a desaparecer por volta do 7° ou 8º ano de vida (SHAFER, 1984)
As lesões se iniciam por erosões avermelhadas, e conseqüente desaparecimento das papilas filiformes e manutenção das fungiformes, com bordas bem definidas e esbranquiçadas de aspecto circinado, que se extendem formando lesões erosivas de diâmetro cada vez maior (Fig. 2). As áreas despapiladas persistem por pequeno período de tempo, normalizam e aparecem em outro local. Esse fato é que determina a denominação de migratória à condição, o que, invalida a princípio qualquer possibilidade de se tratar de anomalia de desenvolvimento, uma vez que estas não mudam sistematicamente de local (SHAFER, 1984). Em dois estudos clínicos realizados nos EUA, a incidência da língua geográfica foi de 2,4% em todos os pacientes examinados por MC CARTHY (1941) . Para HALPERIN et. al. (1953) a ocorrência da anomalia foi 1,4 %. Ainda segundo os autores a relação de pacientes afetados do sexo masculino em relação ao sexo feminino foi de 1:2, sem que fossem notadas diferenças raciais. A lesão ocorre com freqüência maior em crianças. Em 1970, REDMAN, constatou uma prevalência de 1,4 % em um grupo de 3.600 escolares estudados com idades entre 5 e 18 anos. Entretanto, não detectou predileção por sexo.
Por se tratar de patologia benigna, e sem maiores conseqüências, não há necessidade de tratamento específico. Se faz necessário apenas seu controle ou tratamento sintomático quando indicado.
Objetivando se evitar preocupações desnecessárias e deduções errôneas, o paciente deve ser esclarecido sobre a origem e comportamento da lesão. Não obstante, muitos autores têm relacionado a presença de língua geográfica, com psoríase e Síndrome de Down.
REDMAN (1970) estudando 3.668 estudantes da Universidade de Minnesota, de idade entre 17 e 21 anos, constatou a presença de língua geográfica em 42 ( 1,15%). Já GALLINA (1968) , em 3.274 pacientes, encontrou a anomalia em 2,87% e PUGLIESE et al. (1972), analisando 3.429 escolares, detectaram a língua geográfica em 5,22% . Ressaltam que nessa amostragem houve pequena predileção pelo sexo masculino , porém estatisticamente não significativa.
ZHU et al. (1996), observaram que a forma e a configuração das lesões podem mudar visivelmente, apresentando quadros diferentes de um dia para o outro, fato esse comprovado por CAMARGO (1976).
BANÓCZY (1975) , analisou 70 casos de língua geográfica em um período médio de 32 meses, verificando que em 43 casos a condição manteve-se persistente. Clinicamente, não detectaram durante este período transformação maligna ou qualquer outra degeneração.
Raramente o paciente observa a alteração em estágios iniciais, uma vez que os sintomas, quando existentes, se reduzem a um pequeno ardor, particularmente ao ingerirem alimentos condimentados. Usualmente a língua geográfica não requer tratamento, mas, se houver glossodínia (ardência bucal), analgésicos e dieta livre de condimentos e ácidos aliviam os sintomas. Tratamento por complexo vitamínico B como já se disse foi tentado no passado , mas sem nenhum resultado animador, mesmo porque não existe tratamento específico para glossite migratória benigna.
REVISÃO DA LITERATURA
LOFFREDO & MACHADO, em 1983, estudaram a prevalência de língua geográfica, língua fissurada e glossite rombóide mediana em 894 escolares. A língua geográfica incidiu-se em 3,80% , a língua fissurada em 1,45% e a glossite rombóide mediana em 0,56 % dos escolares.
Em 1983, SHAFER descreveu que a glossite migratória benígna consiste clinicamente em múltiplas áreas de descamação das papilas filiformes em configuração circinada. A porção central da lesão mostra-se as vezes inflamada, enquanto que a margem pode estar demarcada por uma linha fina ou faixa branco amarelada. As papilas fungiformes persistem nas áreas descamadas como pequenos pontos avermelhados.
PORTELLA & TELES, em 1986 estudaram a ocorrência da língua geográfica em crianças. Foram examinadas 3.809 crianças na faixa etária de 6 a 12 anos de idade, das quais 1.856 do sexo masculino e 1.953 do sexo feminino. A língua geográfica estava presente em 30 das crianças examinadas, sendo 12 do sexo masculino e 18 do sexo feminino.
GONZAGA & CONSOLARO em 1993 , concluem que a língua geográfica pode ser uma forma frusta da psoríase e orientam a realização de um exame clínico dermatológico detalhado nos portadores de língua geográfica, bem como uma minuciosa pesquisa dos antecedentes familiares para provável detectação da psoríase.
KLEINMAN et al., em 1994 analisaram em 206 crianças na faixa etária entre 5 a 17 anos e observaram prevalência de língua geográfica em 0,6% das crianças.
GONZAGA et al., em 1994 apresentaram o estudo da avaliação bucal, com ênfase na determinação da prevalência da língua geográfica e fissurada, realizado em 808 escolares da cidade de Araraquara. Os pacientes foram submetidos a exame estomatológicos completo. A língua geográfica foi observada em 4,3 % da população estudada, a língua fissurada em 9,6 %, e a associação das duas condições em 1,6 %. Com relação ao sexo a prevalência da língua geográfica foi maior no sexo feminino (5,6 %) do que no sexo masculino (3,3 %). A prevalência da língua fissurada não apresentou diferenças significativas no sexo feminino e masculino .
BEAUDOIN et al. ,em 1995 observaram a grande freqüência de língua geográfica ou glossite migratória benigna em pacientes examinados. Verificaram também que as lesões migram freqüentemente de local sem ter uma área específica ou causa aparente.
GONZAGA & TORRES, em 1994 apresentaram estudos clínicos realizados em 125 pacientes portadores de língua geográfica. Concluíram que 48% eram do sexo masculino e 52% feminino. Em relação a raça , 91,2% eram brancos e 4,8 % eram negros e 4% amarelos. Suas idades oscilavam de 2 a 81 anos, com média de 21,3 anos. Os pacientes foram submetidos a exame clínico geral e estomatológico completos. A sintomatologia estava presente em 45,6 % dos pacientes, e consistia em ardor, especialmente desencadeados por alimentos condimentados, quentes e frutas cítricas.
Observaram psoríase em 14,4 % dos pacientes. A associação língua geográfica e língua fissurada foi observada em 38,4% dos casos.
ERCIS et al., em 1996 relataram estudos, efetuado no Hospital da Universidade de Hacettep, Departamento de Genética em 71 crianças com Síndrome de Down, e observaram que 29 apresentaram hiperqueratose digitopalmar, 7 xerostoses, 22 dermatite seborréica, 14 língua fissurada, 8 língua geográfica e 8 cutis marmorata.
ZHU et al., em 1996 observaram que 1,3 % da população do mundo apresenta psoríase e que os principais focos de manifestações orais nestes pacientes são língua geográfica, língua fissurada, lesões na mucosa e gengiva, e 5% de inflamações na articulação temporomandibular.
YONAI et al em 1997, relataram um caso de psoríase associada a lesões bucais em um doente. Neste caso o envolvimento de lesões no lábio superior, lesões eritematosas na mucosa labial, língua geográfica ectópica, língua fissurada são comumente observados em alguns pacientes com psoríase
Pelo exposto podemos observar que a língua geográfica é uma patologia totalmente benigna e sem conseqüências outras no entanto, cabe ao Cirurgião Dentista , o diagnóstico e orientação do paciente quanto a sua condição e eventuais sintomas.
CONCLUSÕES
A revisão da literatura, através da presente pesquisa, nos permite deduzir as seguintes conclusões:
- A língua geográfica é uma alteração relativamente comum que compromete principalmente crianças em idade escolar;
- A língua geográfica apresenta uma morfologia bastante variada;
- A língua geográfica, não possui tratamento específico, apenas sintomático;
- O paciente deve tomar ciência da característica benigna da anomalia;
- A prevalência da alteração em relação ao sexo, não apresenta evidências significativas.
REFERÊNCIAS BIBLIOGRÁFICAS
- BANÓCZY, J. “Migratory glossitis. A clinical – histologic review of seventy cases”. Oral Surg., 39 (1):113-21, Jan,1975.
- BEAUDOIN, N. ; NANOUKIAN, K.; LALONDE B.: “La glossite benigne migratorie: une lesion enigmatique”. J Can Dent Assoc.; 61(9) : 802-3, 806-8, Sep, 1995
- CAMARGO, H. A “Prevalência da língua geográfica , língua fissurada e glossite rombóide média em escolares de São José dos Campos.” Ars Curandi Odontologia, 3(1):56-63, mai/jun, 1976.
- CHERASKIN, T. & Zegarelli, W, Diagnóstico em Patologia Bucal, Ed. Guanabara Koogan, 1 Ed, 1970.
- ERCIS, M. ; BALCI, S. ; ATAKAN, N. “Dematological manifestations of 71 Down Syndrome Children admitted to a clinica; genetics unit”; Clin Genet.; 50 (5): 317- 20, Nov, 1996.
- GALLINA, L. “Estatística sobre frequência de língua escrotal, língua geográfica, língua negra pilosa, glossite rombóide mediana e anquiloglossia em 3,274 pacientes estomatológicos.” Rev. Internazionale Stomat. Pratica, 19:261-7, 1968.
- GONZAGA, H. F. S. ; COSTA, C. A .S. ; OLIVEIRA, M. R. B. ; NORDI, P. P. ; PIRES, R. H. ; MILORI, A ; AFONSO, J. W. ; LIA , R. C. C. : Estudo da Prevalência da língua geográfica da língua geográfica em escolares de Araraquara. Rev. odonto. Unesp ; 23(2): 339-46, Jul / Dez, 1994.
- GONZAGA, H. F. S. ; CONSOLARO, A : “Língua geográfica pode ser uma forma frustra de psoríase ? ”; RGO (Porto Alegre), 41 (4): 204 – 6 , Jul./ Ago, 1993 .
- HALPERIN, V. ; HUDDLESTON, S. D. ; ROBINSON , H. B. : The ocurrence of Fordyce spots, benign migratory glossitis, median rhomboid glossits, and fissured tongue in 2.478 dental patients. Oral Surg., 6, 1072,
- KLEINMAN, D.V. ; SWANGO, P. A. ; PINDBORG, J. J. : “Epidemiology of oral mucosal lesions in United States school children ”.; Community Dent Oral Epidemiol; 22 (4): 243- 53, Aug, 1994.
- LOFFREDO, L. C. M. ; MACHADO, J. A.C. : “Prevalência da língua geográfica, língua fissurada, língua romboide mediana em escolares de Ibt,-SP ”. Rev.Odont. Unesp; 12 (1/2): 71-5, Jan / Dez, 1983.
- MCCARTHY, F. P. : A clinical and pathologic study of oral disease. J.A . M. A ., 116:16, 1941.
- MITCHELL, D. F. ; STANDISH, S. M. ; FAST, B.T.Oral Diagnosis/Oral Medicine. Philadelphia, Lea & Febiger , 1969.
- PORTELLA, W.: Incidência de Língua geográfica em crianças na faixa etária de 6 a anos de idade . Rio de Janeiro; Rev. Bras. Odont.; 26 p., Março, 1983.
- PORTELLA,W. ; TELES, C. B. J.: Incidência da língua geográfica em crianças na faixa etária de 6 a 12 anos de idade. Rev.Bras. Odont.; 43 (2) : 42: 50, Mar / Abr, 1986.
- PUGLIESE, N. S. ; ARAÚJO, V. C. ; BIRMAN, E. G. ; ARAÚJO, N. S. “Prevalência da língua geográfica , língua fissurada , língua pilosa e da glossite mediana rômbica em escolares do município de São Paulo.” Rev.Fac.Odont. S. Paulo, 10(2): 139-42, Jul / Dez, 1972.
- REDMAN, R. S. : Prevalence of geographic tongue, fissured tongue, median ]rhomboid glossitis, and hairy tongue among 3.611 Minnesota school children. Oral Surg., 30:390. 1970
- SHAFER, H. L. : A Textbook of Oral Pathology, Copyright by W.B. Saunders Company 25:26. 1983
- YONAI, F. S. ; PHELAN J. A .: “Oral mucositis with features of psoriasis: report of a case and review of the literature ”.Oral Surg Oral Med Pathol. Oral Radiol Endod.; 84(1):61-7, Jul, 1997
- ZHU, J. F. ; KAMINSKI, M. J. ; PULITZER, D. R. ; HU J. ; THOMA, H. F. : “Psoriasis: pathophysiology and oral manifestations” Oral Dis.; 2(2): 135-44, Jun, 1996
Endereço para correspondência:
Av. Dom Pedro I, 181 – apto: 1001
Ipiranga
CEP: 01552-001
e-mail: arturcerri@uol.com.br
Fig. 1 – Aspecto Geográfico da Glossite Migratória Benigna
Fig. 2 – Aspecto Erosivo da Língua Geográfica, circundado por área esbranquiçada.
Líquen plano bolhoso oral: relato de caso clínico.
Líquen plano bolhoso oral: relato de caso clínico
RIBEIRO-DA-SILVA, Carlos Eduardo Xavier dos Santos
Especialista e Mestre em Estomatologia
Professor Adjunto de Estomatologia da UNISA e UNICASTELO
CERRI, Artur
Especialista, Mestre e Doutor em Estomatologia
Professor Titular de Estomatologia da UNISA e UNICASTELO
PACCA, Francisco Octávio Teixeira
Especialista e Mestre em Estomatologia
Doutorando em Estomatologia pela USP
Professor Adjunto de Estomatologia da UNISA e UNICASTELO
SILVA, Patrícia
Cirurgiã-Dentista
CERRI, Rodrigo Alarco
Aluno do Curso de Especialização em Estomatologia da UNISA
ENDEREÇO DOS AUTORES:
Rua Pelotas, 358 – Vila Mariana – São Paulo – SP
CEP 04012-010 – FONE: (11) 5571-1736
dreduardosilva@terra.com.br
LÍQUEN PLANO BOLHOSO ORAL: RELATO DE CASO CLÍNICO
ORAL BULLOUS LICHEN PLANUS : REPORT OF A CLINICAL CASE
RESUMO
O Líquen Plano é uma doença dermatológica, que pode acometer tanto a pele, como estar associada a lesões mucosas, ou ainda ocorrer apenas nas mucosas. Dentre as formas clínicas do líquen plano oral a mais rara é certamente o líquen plano bolhoso ( LPB ). Seu diagnóstico precoce é fundamental, pois esta variante clínica é reconhecida como sendo uma das formas atípicas de líquen, que possui maior potencial de malignização. Seu tratamento imediato deve ser feito no sentido de se evitar o desconforto que a lesão provoca, bem como sua possível malignização. Relatamos um caso raro de líquen plano bolhoso oral com seus aspectos clínicos, diagnóstico diferencial, sintomatologia e tratamento.
SUMMARY
The Lichen Planus is a dermatological illness that can attack the skin in such a way as to be associated the mucous injuries, or still to occur only in the mucosae. Amongst the clinical forms of rarest the oral planus lichen it is certainly the bullous planus lichen (LPB). Its precocious diagnosis is basic therefore this clinical form is recognized as being one of the atypical forms of lichen, that it according to some authors malignization potential. Your immediate treatment must be made in an effort to avoid the discomfort what the lesion aggravated, as well as she sweats possible malignization.
The present work has as objective to report a case of a bullous planus lichen with its clinical aspects, differential diagnostic, and treatment.
UNITERMOS
Líquen Plano – Líquen plano bucal – Auto-imunidade
KEY WORDS
Lichen planus – Oral lichen planus – Autoimmunity
INTRODUÇÃO
Das doenças dermatológicas, o Líquen Plano é a que mais comumente envolve a mucosa oral acompanhando, precedendo ou sucedendo as lesões cutâneas e por isso é de fundamental importância que o Médico e o Cirurgião-Dentista saibam fazer o correto diagnóstico. Algumas vezes, este pode ser estabelecido apenas pelo exame clínico sem a necessidade da realização de biópsia, ou outro exame complementar.
O termo líquen plano bem como a descrição da patologia, foram feitos primeiramente pelo médico inglês Erasmus Wilson durante o 34º Anual Meeting of British Medical Association em 1866. Ele a descreveu detalhadamente e sugeriu que sua etiologia poderia ser decorrente de “tensões nervosas”.(SCULLY,1985)
Segundo HUBER (2004) a prevalência das lesões orais de líquen plano na população mundial, é de aproximadamente 0,5 a 1%.
Cerca de 50% dos pacientes apresentam lesões cutâneas e lesões orais, 25% apresentam apenas lesões orais e 25 % apenas lesões cutâneas.( HUBER, 2004; SCULLY, 1985 )
SCULLY em 1985, afirmou que as lesões orais podem perdurar por até 25 anos, sem evidência clínica de malignização.
Em um estudo realizado por SILVERMAN (2000) com 200 pacientes foi verificado que 65% dos casos atingiam o sexo feminino sendo que os pacientes apresentavam idades entre 40 e 70 anos.
O líquen plano oral segundo REGEZI E SCIUBBA (2000) é uma doença que se manifesta principalmente em adultos, sendo as crianças raramente afetadas.
WRIGHT em 2004, afirmou que o líquen plano pode acometer qualquer região da cavidade oral. A mucosa jugal, língua e gengiva são as regiões mais comumente afetadas, enquanto que as lesões na fibromucosa do palato são menos freqüentes.
SILVERMAN (2000) afirmou que normalmente as lesões são simétricas e bilaterais, de aspecto circinado e serpiginoso.
ANDREASEN (1968) foi quem subdividiu primeiramente o líquen plano oral em 6 subtipos : reticular, papular, placa, erosivo, atrófico e bolhoso.
As formas reticular, papular e placa são normalmente assintomáticas e se apresentam clinicamente como lesões brancas de queratina, estas formas são classificadas como típicas.
Já as formas: erosiva, atrófica e bolhosa que são sempre associadas à sensação de ardência e em muitos casos podem causar dores severas, são chamadas de formas atípicas, sendo reconhecidas pela literatura como as que possuem maior potencial de malignização.
A história detalhada e a observação dos sinais e sintomas da doença são normalmente suficientes para estabelecer o diagnóstico. Porém recomenda-se, em caso de dúvida, a realização de biópsia. Há controvérsias na literatura quanto ao potencial de malignização do líquen plano oral. O tratamento pode ou não ser cirúrgico e a escolha varia de acordo com o tipo e a extensão do líquen e a condição sistêmica do paciente.
Alguns autores relatam que a psicoterapia pode ser benéfica principalmente nos pacientes mais ansiosos. ( MOLLAOGLU, 2000; PLEMONS et al, 2000 )
ASPECTOS CLÍNICOS
Líquen Plano Reticular
É o tipo mais comum de líquen plano oral. Segundo SCULLY (1985), apresenta-se com as estrias de Wickham brancas com um discreto bordo eritematoso. Atenuado em 41% dos casos, segundo HUBER (2004) com uso de corticosteróides tópicos.
Líquen Plano Papular
Caracterizado por pequenas pápulas brancas com 0,5mm, disseminadas pela mucosa oral. Raramente são observadas no exame de rotina devido ao seu tamanho diminuto.
Líquen Plano em Forma de Placa
Caracterizado por placas brancas de forma irregular podendo ser multifocais segundo HUBER ( 2004 ) , resolvido em 7% dos casos dos uso de corticosteróides tópicos.
Para DISSEMOND (2004) esta forma de líquen plano é mais comum para pacientes que fazem uso do tabaco (cigarro, charuto ou cachimbo).
Líquen Plano Atrófico
Caracterizado por um aspecto difuso, vermelho e normalmente com estrias brancas ao redor da lesão.
Quando acomete a gengiva é conhecido como “gengivite crônica descamativa”. Causa a sensação de ardência, principalmente quando em contato com alguns tipos de alimentos.
Líquen Plano Bolhoso
Caracterizado por pequenas bolhas ou vesículas que tendem a se romper facilmente. Quando da ruptura da bolha ou vesícula que varia de milímetros a centímetros de diâmetro, ocorre a ulceração da área com sintomatologia dolorosa. ( UNSAL; GÜLTEKIN; TOKMAN, 2003 )
Segundo WRIGHT ( 2004) é a forma mais rara de líquen plano oral . É encontrado com maior prevalência na mucosa jugal, nas áreas póstero-inferior de 2º e 3º molares, podendo ainda ser encontrado com certa freqüência no bordo lateral de língua.
Líquen Plano Erosivo
São lesões irregulares com placa fibrosa ou falsas membranas onde aparecem as erosões. Só causa dor quando estas placas ou membranas são removidas. Para LARSSON ( 2003 ) este tipo de líquen plano é o que tem maior potencial de malignização, pois num estudo por eles realizado foram encontrados 101 casos de malignização de líquen plano onde mais de 60 % das lesões eram do tipo erosiva.
DIGNÓSTICO DIFERENCIAL DO LÍQUEN PLANO ORAL
Incluem-se reações liquenóides, leucoplasia, carcinoma espino celular extenso, pênfigo, penfigóide benigno de mucosa, candidíase pseudo-membranosa e leucoedema.
TRATAMENTO DO LÍQUEN PLANO ORAL
Muitos dos pacientes com líquen plano oral não apresentam qualquer sintomatologia, principalmente em suas formas típicas. Muitos dos casos acabam sendo diagnosticados durante uma visita rotineira ao Cirurgião-Dentista ou ao Médico.
O tratamento ou controle da doença pode ser cirúrgico, através do uso de laser, crioterapia, cauterização ou ácido tricloroacético a 70% (ATA).
TAL e RIFKIN em 1986 usaram crioterapia para tratar um líquen plano em forma de placa. Após 2 anos de tratamento não havia sinal de recidiva da lesão. Em relação ao tratamento não cirúrgico muitas drogas vêm sendo utilizadas como : corticosteróides retinóicos, griseofulvina, ciclosporina e pimecrolimus (DISSEMOND, 2004; ESQUIVEL-PEDRAZA et al., 2004 )
Os corticosteróides são considerados os principais agentes terapêuticos no tratamento do líquen plano oral podendo ser prescritos na forma tópica e sistêmica, dependo do quadro clínico. (CARBONE et al., 2003 ).
RELATO DO CASO CLÍNICO
Uma paciente, leucoderma, 56 anos de idade, procurou a Disciplina de Estomatologia da Faculdade de Odontologia da Universidade de Santo Amaro-UNISA (SP), para diagnóstico e tratamento de “ferida na boca” (SIC), com evolução de um ano.
Durante a história médica relatou ser portadora de hipertensão arterial controlada com medicamentos, fato este confirmado quando de sua aferição em 125 X 80 mmHg, em diversas oportunidades. A terapia por ela utilizada por orientação médica é o captopril 50 mg/dia. Não revelou nenhum outro fato de relevância com relação a sua história médica.
Questionada sobre lesões cutâneas, negou qualquer ocorrência. Quanto a seus antecedentes familiares, também não houve nada digno de nota.
Em sua história odonto-estomatológica relatou a exodontia de todos os dentes e o uso de próteses totais nos arcos superiores e inferior. Informou que fora perdendo os dentes no decorrer de sua vida, sempre associados a cárie e que optou pela remoção dos remanescentes e colocação das próteses totais há aproximadamente 4 anos.
O exame clínico intra-oral mostrava mucosas com coloração, consistência, textura e hidratação normais em todas as estruturas, à exceção do rebordo alveolar superior direito, na região de pré-molares onde percebia-se a existência de lesão bolhosa de conteúdo líquido de aproximadamente 10 milímetros de diâmetro, interposta entre lesões ulceradas e outras linhas brancas de aspecto circinado.
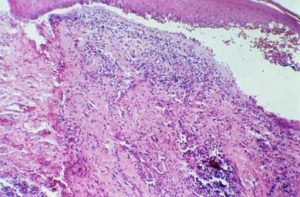
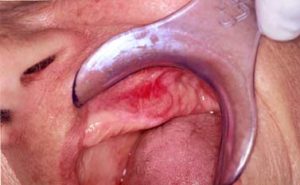
A paciente referiu a ocorrência de outras lesões semelhantes em sua boca, sempre assintomáticas na fase bolhosa, mas que se rompiam com facilidade deixando uma superfície ulcerada e extremamente dolorosa. Tais lesões cicatrizavam espontaneamente num prazo aproximado de 20 dias.
O exame clínico extra oral revelou enfartamento ganglionar bilateral da cadeia sub-mandibular do tipo inflamatório.
Por seu aspecto clínico e histórico, aventamos a hipótese diagnóstica de Líquen Plano Bolhoso ( LPB ), tendo como diagnóstico diferencial o Pênfigo vulgar. Foi realizado, após os cuidados rotineiros, biópsia incisional da lesão com objetivo de se confirmar a suspeita clínica de LPB.
O exame anátomo-patológico mostrou tratar-se de lesão com a formação de inúmeras bolhas sub-epiteliais, acantose, degeneração hidrópica da camada basal e denso infiltrado de linfócitos, confirmando o diagnóstico de Líquen Plano Bolhoso.
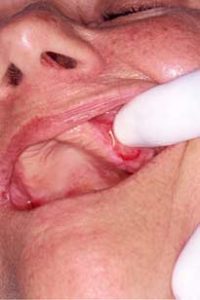
Compressão da bolha.
A paciente foi medicada com 20 mg/dia de Prednisona durante 10 dias, prazo no qual houve o desaparecimento completo das lesões, a terapia foi então reduzida para 10 mg/dia durante 10 dias, 5 mg/dia por 10 dias e finalmente suspensa. A paciente permaneceu em acompanhamento por 12 (doze) meses, período no qual não houveram recidivas da lesão, permanecendo sobre constante observação. Durante o uso da medicação foi realizada periodicamente a aferição da pressão arterial que não apresentou alterações significativas.
DISCUSSÃO
Em consonância com HUBER (2004) e SCULLY (1985) nem todos os pacientes apresentam lesões cutâneas e orais e o caso clínico apresentado relata líquen plano somente na cavidade oral.
KÖVESI e BANOCZY (1973) constataram que 63% dos casos de líquen plano oral acometiam pacientes do sexo feminino, confirmado mais tarde por um estudo feito por SILVERMAN (2000) onde este resultado subiu para 65% . Em ambos os estudos os pacientes apresentavam idade entre 40 e 70 anos. O caso clínico revela que a paciente é do sexo feminino com 56 anos de idade, concordando com ambos os autores, no que diz respeito à faixa etária e sexo predominante.
DORTA et al. em 2000 afirmavam que a doença pode acometer qualquer região da cavidade oral sendo as regiões anatômicas mais comuns a mucosa jugal, língua e gengiva. Em nosso caso a paciente apresenta lesão em rebordo alveolar superior direito, o que pode ser considerada uma área.
A literatura apresenta como forma de tratamento o cirúrgico e o não cirúrgico, variando de acordo com o tipo e extensão da lesão, além da condição sistêmica do paciente. Para DISSEMOND (2004); e CARBONE (2003) quando da opção pela terapêutica medicamentosa, o mais indicado é o uso de corticosteróide. Ainda HOFMAN-WELLENHOF et al. em 1999 consideravam também o corticosteróide o agente mais indicado, enquanto que ESQUIVEL-PEDRAZA et al. (2004) recomendavam o uso de pimecrolimus tópico a 1%.
No caso apresentado, a paciente foi medicada com 20mg/dia de Prednisona por via oral durante 10 dias sendo a dose reduzida gradativamente de acordo com o desaparecimento completo da lesão até ser definitivamente suspensa.
CONCLUSÃO
O Líquen Plano Bolhoso é uma doença dermatológica que raramente acomete a mucosa oral, mas quando de sua ocorrência provoca considerável desconforto aos pacientes e sua forma de tratamento varia de acordo com alguns fatores.
No caso clínico relatado, após o diagnóstico optou-se pela terapia medicamentosa com corticosteróide (uso de Prednisona) com a finalidade de minimizar a sintomatologia dolorosa até o completo desaparecimento da lesão, além de acompanhamento clínico por 1 ano, onde não houve constatação de recidiva.
REFERÊNCIAS BIBLIOGRÁFICAS
1.ANDREASEN, J.O. Oral lichen planus. A clinical evaluation of 115 cases. Oral Surg Oral Med Oral Pathol 25(1):31-42,1968 Jan.
2.CARBONE, M. et al. Systemic and topical corticosteroid treatment of oral lichen planus: a comparative study with long-term follow-up. J Oral Pathol Med; 32(6):323-9, 2003 Jul.
3.DISSEMOND, J Oral lichen planus: an overview. J Dermatolog Treat; 15(3):136-40, 2004 Jun.
4.DORTA, R.G; COSTA, C.G; OLIVEIRA, D.T. Conduta médica em pacientes com líquen plano cutâneo e bucal / Medical management in patients with cutaneous and oral lichen planus Rev. Fac. Odontol. Bauru;8(3/4):23-28, jul.-dez. 2000.
5.ESQUIVEL-PEDRAZA, L. et al.Treatment of oral lichen planus with topical pimecrolimus 1% cream. Br J Dermatol; 150(4):771-3, 2004 Apr.
6.HUBER, M.A. Oral lichen planus. Quintessence Int; 35(9):731-52, 2004 Oct.
7.KÖVESI, G; BANOCZY, J. Follow-up studies on oral lichen planus. J. Oral Surg 2(1):13-9,1973.
8.LARSSON, A; WARFVINGE, G. Malignant transformation of oral lichen planus. Oral Oncol; 39(6):630-1, 2003 Sep.
9.MOLLAOGLU, N. Oral lichen planus: A Review. Br J Oral Maxillofac Surg; 2000;38 2:370-377 Aug.
10.PLEMONS, J.M.; GONZALES,T.S; BURKHART, N.W. Vesiculobullous diseases of the oral cavity. Periodontal 2000; 21: 158-75, 1999 Oct.
11.REGEZI, J.A; SCIUBBA, J.J. Oral Pathology: Clinical Pathologic Correlations. Philadelphia : WB Saunders Company, 2000.
12.SCULLY, C; EL-KON, M. Lichen Planus: Review and update on pathogenesis. J Oral Pathol;14(6):431-58,1985 Jul.
13.SILVERMAN, S. The bullous desquamative lesions of oral mucosa. J Calif Dent Assoc; 28 (12) : 928-32, 2000 Dec.
14.TAL, H; RIFKING, B. Cryosurgical treatment of a gingival lichen planus: report of case. J Am Dent Assoc 1986; 113:629-631.
15.UNSAL B.; GÜLTEKIN, S.E.; BAL, E; TOKMAN, B. Bullous oral lichen planus: report of two cases. Chin Med J (Engl); 116(10):1594-5, 2003 Oct.
16.WRIGHT J. Oral lichen planus. Br Dent J; 197(5):224-5, 2004 Sep 11.
Mixoma odontogênico com invasão sinusal
Mixoma odontogênico com invasão sinusal
- Bruna fontes da silva
- Artur cerri
- Carlos eduardo xavier s. ribeiro da silva
- Adriana lopes macedo
- Disciplina de estomatologia
Resumo
Os autores apresentam o caso clínico de um paciente do sexo masculino, 36 anos, leucoderma, que procurou a clínica de odontologia da Universidade de Santo Amaro, queixando-se de aumento de volume na região maxilar esquerda. Inicialmente, o mesmo foi avaliado pela disciplina de Semiologia que o encaminhou para a disciplina de Estomatologia (Diagnóstico Bucal) a fim de determinar o diagnóstico.
Durante o exame pela disciplina de Estomatologia, verificou-se a presença de lesão tipo massa nodal localizada no rebordo alveolar superior esquerdo, sendo impossível a determinação clínica de seus limites. Foram solicitados os seguintes exames complementares de rotina: radiografia panorâmica dos maxilares, raio-x para seios da face (tomada de Waters) e hemograma completo, o qual se demonstrou dentro dos padrões de normalidade.
Ao raio-x verificamos invasão do seio maxilar pela lesão. Foi executada biópsia incisional cujo resultado foi de mixoma odontogênico. Após quinze dias, realizou-se a remoção cirúrgica da lesão e sinusectomia maxilar.
Não houveram intercorrências no pós- operatório. O paciente foi acompanhado durante seis meses e não houve sinais de recidiva.
Introdução
O mixoma odontogênico é uma neoplasia benigna de origem mesenquimal, localmente invasiva, com células arredondadas em um estroma mucóide. É um tumor não encapsulado, sem delimitação precisa, contendo tecido fibroso em quantidades variáveis e tecido mixomatoso.
Epidemiológicamente, incide em proporções semelhantes tanto no homem quanto na mulher, sendo encontrado com maior freqüência no corpo e ramo mandibular. Incide preferencialmente na faixa etária de 20 a 30 anos.
A lesão possui aspecto gelatinoso, de coloração branco-amarelada.
Radiograficamente apresenta aspecto multilocular, com áreas radiolúcidas separadas por septos radiopacos, apresentando entrecruzamentos, formações angulares (retas) lembrando o aspecto denominado de “raquete de tênis”. Os limites não são nítidos, indicando uma lesão invasiva, provocando, provocando deslocamento de dentes e reabsorções radiculares em dentes vizinhos, podendo romper corticais ósseas.
O tratamento é radical, com uma cirurgia excisional, com margem de segurança para evitar a recidiva da lesão.
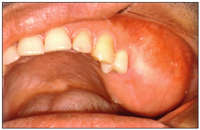
Aspecto inicial da lesão
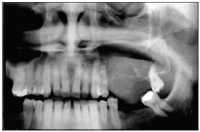
Radiografia inicial
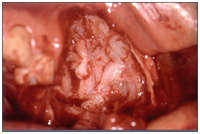
Aspecto do tecido mixomatoso
Peça removida
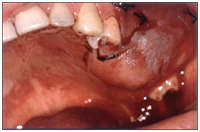
Pós-operatório imediato
Discussão
O mixoma odontogênico acomete largo espectro de idades, sem predileção por sexo segundo Elsay e Dutz em seus estudos de 15 casos de mixoma em tecido mole.
Em 1988, Cuestas-Carnero, Bachur e cols. afirmam que o mixoma odontogênico ocorre predominantemente em mandíbula e em jovens (67%), sem predileção por sexo.
Em 1986, Siar, Devadas e cols. relataram um caso de mixoma odontogênico em tecido mole, e, os locais mais afetados são a mucosa jugal, assoalho bucal e palato.
Lo Muzio, Nocini e cols. revisaram 10 casos e observaram que a média da idade destes pacientes era 32.7 anos, com maior prevalência em pessoas do sexo feminino; 60% dos mixomas odontogênicos ocorreram em mandíbula e 40% em maxila. Williams afirma que a prevalência ocorre na segunda e terceira décadas de vida. Radiograficamente apresenta-se como uma lesão radiolúcida multilocular ou unilocular com limites difusos, podendo apresentar aspecto de favo de mel ou bolhas de sabão (2,5).
O tratamento pode variar: excisão, enucleação seguida de curetagem ou cauterização química do tecido ósseo envolvido, ressecção em bloco da área afetada (1).
No caso de lesões pequenas sem envolvimento ósseo, o tratamento conservador é indicado (excisão completa, enucleação ou curetagem seguida de cauterização química das paredes ósseas circundantes afim de manter a função do paciente) (1,3,4). Siar, Devadas e cols. realizaram a excisão completa do mixoma odontogênico e houve uma proservação durante 4 anos, sem recidivas.
O tratamento conservador é complicado pois a neoplasia não é encapsulada e o tecido mixomatoso infiltra em tecido ósseo próximo; Devido a sua natureza gelatinosa, a remoção intacta desta neoplasia é difícil. Nestes casos, com um tratamento conservador há maiores chances de recidiva (2,3). Slootweg e Wittkampf recomendam enucleação e curetagem para lesões em mandíbula e uma terapia mais agressiva para lesões em maxila. Desse modo, explica-se a necessidade de ressecção na maioria dos casos (5). Em uma revisão de 10 casos de mixoma odontogênico, Lo Muzio, Nocini e cols. relatam 43% de recidiva em casos que se realizaram enucleação. Segundo a literatura, a recidiva após tratamento conservador varia, com uma média de 25%5.
Conclusão
Com base na literatura consultada, concluímos que:
1.Radiograficamente, as lesões mais freqüentes são multiloculares com limites difusos.
2. Apesar de ser uma lesão benigna, possui um comportamento infiltrativo e invasivo, podendo causar destruição de tecido ósseo.
3. O tratamento do mixoma, é predominantemente radical com margem de segurança para evitar recidiva.
Abstract
A 36-year-old man complained of an nonpainful mass that had been first noticed 1 year previously. Examination showed a lesion on the posterior left region in the alveolar ridge covered with normal overlying mucosa. Radiologic analysis was made on Waters and panoramic radiographs and showed invasion of the maxillary sinus. After 15 days, an excisional biopsy and maxillary sinusectomy were performed.
There was no postoperative complications. The patient was followed up during 6 months and no recurrence has been reported so far.
Referências bibliográficas
1.Cuestas-Carnero R, Bachur RO, Gendelman H. Odontogenic Myxoma: report of a case. J Oral Maxillofac Surg 1988;46:705-9.
2.Eversole L. Contemporary Oral and Maxillofac Pathol 1997;5:143-44.
3.Lo Muzio, Nocini P, Favia G e cols. Odontogenic Myxoma of the jaws: A clinical, radiological, immunohistochemical and ultrastructural study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1996;82:426-33.
4.Siar CH, Devadas VBDS e cols. Oral soft tissue myxoma. Report of case.J Oral Med 1986;41(4):256-58.
5.Williams, TP. Odontogenic Myxoma. Oral Maxillofac Surg Clin North Am; 332
- Monitora da Disciplina de estomatologia da Unisa.
- Mestre em Estomatologia, Prof. Adjunto de Estomatologia da Unisa.
- Doutor em Estomatologia, Prof. Titular em Estomatologia da Unisa.
Molusco contagioso em paciente hiv positivo
Molusco contagioso em paciente hiv positivo
- Prof. Carlos Eduardo Xavier dos Santos Ribeiro da Silva
Mestre em Semiologia pela UCCB
Prof. De Semiologia da UNISA, UCCB e UNG - Prof. Ronoel Samartini
Especialista em Semiologia pela USP
Prof. de Semiologia da UNISA e UCCB - Prof. Dr. Artur Cerri
Especialista, Mestre e Doutor em Semiologia pela USP
Prof. Titular de Semiologia da UNISA, UCCB E UNG - Prof. Henrique Prats
Mestre em Semiologia pela USP
Prof. de Semiologia da UNIS
Resumo
Os autores relatam um caso clínico de molusco contagioso, em paciente que procurou a UNISA (Universidade de Santo Amaro) para tratamento odontológico de rotina. Frente ao diagnóstico desta doença dermatológica, associada a anamnese sugestiva de comportamento de risco para a infecção pelo HIV, foi solicitado o exame ELISA, que comprovou a suspeita.
Unitermos Moluscum contagiosum – Doença dermatológica – Infecção pelo HIV.
Introdução
A Síndrome de Imunodeficiência Adquirida ( Sida ), apareceu inicialmente em 1981, quando o Centro de Controle de Doenças ( CDC ) da cidade de Atlanta, nos Estados Unidos, foi informado da ocorrência de 26 casos de Sarcoma de Kaposi e de 5 casos de pneumonia por Pneumocystis carinii. Esses casos ocorreram em Los Angeles e Nova Iorque, sendo que todos os indivíduos comprometidos eram jovens homossexuais do sexo masculino. ( 1,3,4,5,7,8,16,17,18 )
A Sida é uma doença que reduz drasticamente o número de glóbulos brancos , ocasionando um grande aumento no aparecimento de doenças oportunistas e de neoplasias malignas. Entende-se por oportunistas aquelas doenças causadas por microorganismos que convivem com o organismo humano, mas que normalmente são incapazes de provocar danos em indivíduos considerados sadios . ( 1,3,4,5,7,8,16,17,18 )
A Sida é causada por um retrovírus e que portanto possui seu patrimônio genético registrado em ARN. Sua especificidade em relação aos outros vírus é dada pela presença da enzima transcriptase reversa que transcreve o ARN viral numa molécula de ADN, que pode ser incorporada aos cromossomos da célula hospedeira.
Estruturalmente, os retrovírus são esféricos, têm diâmetro médio de cem nanômetros ( um nanômetro é igual a um bilionésimo do metro ) e consistem de um nucleocapsídeo no interior de um envoltório glico-lipo-protéico, mais a molécula de ARN( 2,12,13,21 )
Em 1986, a Organização Mundial de Saúde (OMS) determinou que o vírus passasse ser chamado de HIV (vírus da imunodeficiência humana).
O HIV foi isolado no sangue, sêmem, secreções vaginais, saliva, lágrima, leite materno e urina, mas evidências epidemiológicas têm implicado principalmente o sangue, o sêmem e a secreção vaginal pela transmissão, devido a sua grande carga viral( 1,3,4,5,7,8,16,17,18 ). O meio clássico de se identificar pacientes infectados pelo HIV é a sorologia ( Elisa e Western-Blot ), onde se observa a presença de anticorpos anti-HIV.
A transmissão do HIV ocorre mais comummente através de contatos sexuais, uso de drogas injetáveis e de transfusões de sangue, a chamada transmissão horizontal ou durante a gestação ou transmissão vertical. Excetuando-se as crianças infectadas durante sua formação, a Sida acometia em sua imensa maioria indivíduos que possuem o chamado comportamento de risco. Ou seja, homossexuais, bissexuais, usuários de drogas endovenosas e pacientes submetidos a transfusão de sangue(11,13).
Hoje, porém, constata-se uma explosão de casos nos pacientes de comportamento heterossexual. Em 1985, a transmissão heterossexual era responsável por 1,9% dos novos casos de Sida. Em 1996, essa taxa aumentou para 22%(11,13).
O HIV, atua destruíndo os linfócitos T4 impedindo assim o perfeito funcionamento do sistema imunológico e deixando o organismo vulnerável a uma imensa gama de patologias( 1,3,4,5,6,7,8,14,16,17,18)
As características clínicas mais comuns da doença são representadas por febre (96%); linfoadenopatia (74%); faringites (70%); ulcerações muco-cutâneas envolvendo boca, esôfago e genitais (70%); mialgias ou artralgias (54%); diarréia (32%); cefaléia (32%); náusea e vômito (27%); hepatoesplenomegalia (14%); candidíase oral (12%), além de cansaço extremo e prolongado, emagrecimento progressivo inexplicável (de 3 a 4 kg. por mês ), suor noturno intenso com intervalo de dias ou semanas e tosse prolongada presentes em todos os pacientes. Alguns desenvolvem ainda, pneumonia por Pneumocystis carinii, Sarcoma de Kaposi ( SK ) e Molusco Contagioso ( MC ) ( 9,10,15,19,20 ).
O MC vem sendo encontrado com frequencia em pacientes com infecção avançada pelo HIV e parece haver relação entre a extensão das lesões e a imunidade celular, pois quanto maiores as lesões de molusco, menor é a contagem de células CD4 ( linfócitos T4 ).
O Molusco Contagioso é uma infecção dermatológica causada por um vírus DNA de dupla hélice da família poxivírus, que raramente acomete a mucosa e que, excluído-se os pacientes portadores de Sida, ocorre principalmente em crianças. Clinicamente a lesão se apresenta como uma massa nodular exofítica de centro umbelicado e de coloração semelhante a da pele normal. Pode ser única ou múltipla e estar ou não associada a outras patologias dermatológicas( 9,10,15,19,20 )..
Habitualmente é assintomática, tornando-se dolorosa, apenas quando infectada. As áreas comumente mais atingidas são as pálpebras, a face, o pescoço e a região genital, quando atinge a pele, e os lábios e mucosa jugal quando ocorrem em mucosa. Associa-se a disseminação do MC na face com o ato de barbear-se.
A confirmação do diagnóstico clinico de MC é feita através de biópsia, que apresenta corpúsculos de inclusão característicos. A presença de lesões de MC significa uma depressão importante do sistema imunológico, por si só já sendo suficiente para a hipótese de diagnóstico de HIV, que obviamente deve ser confirmado com exames sorológicos específicos( 10, 15, 19, 20 ).
O tratamento das lesões de MC é cirúrgico, através de curetagens e cauterização ou com crioterapia, aplicando-se nitrogênio líquido. Outra possibilidade é o emprego de podofilina ou ácido tricloroacético. A recorrência da patologia é regra.
Até o momento, o tratamento da Sida apresenta prognóstico duvidoso, procurando apenas aumentar e melhorar a sobrevida dos pacientes, além de evitar o aparecimento de doenças oportunistas. Uma associação de 3 medicamentos ( AZT, 3TC e Saquinavir ) tem sido utilizada pelos pesquisadores com resultados positivos quanto à diminuição da quantidade de vírus circulante. Essa associação que combina dois inibidores de transcriptase reversa e um inibidor de protease tem proporcionado nova expectativa aos pacientes.
Apesar de não existir cura, nos últimos anos a sobrevida dos pacientes tem aumentado significantemente, graças aos avanços técnico-científicos da medicina(13).
Caso Clínico
Paciente R.S.A , sexo masculino, 25 anos, melanoderma , procurou a clínica odontológica da Universidade de Santo Amaro ( UNISA ) para tratamento de rotina. Encaminhado para a disciplina de Semiologia para exame clínico, verificou-se sobre sua história médica, que ele havia sido hospitalizado há mais ou menos 10 anos para tratamento de pneumonia. Com relação aos hábitos informou ser viciado em crack, cocaína e maconha.
Relatou ainda ter feito uso de cocaína injetável compartilhando a mesma seringa com o grupo de três viciados. Sendo que o compartilhamento da seringa deu-se da seguinte forma : Um dos viciados aspirava aproximadamente 5 ml de seu sangue, diluía a droga e posteriormente a entregava aos outros para que cada um se injetasse 1 ml. Apresentava emagrecimento inexplicável de aproximadamente 5 quilos no período de trinta dias.
Além de anorexia, prostração, enfraquecimento, náuseas e diarréia persistente. Está atualmente internado numa clínica evangélica de recuperação de viciados. Quanto ao exame físico apresentava, no momento da consulta, PA de 130 por 85 MMHg, pulso de 87 BPM e temperatura axilar de 36,2 graus. Ao exame extra-bucal apresentava numerosas pápulas de aproximadamente 3 mm de diâmetro, circunscritas, e indolores, na região supra hioidéia que se estendiam por toda a região cervical anterior do pescoço.
O exame intra-oral não apresentou nenhuma alteração de sua morfologia normal.
Questionado se apresentava essas lesões em outras partes do corpo, relatou ter lesão semelhante há mais de um ano no prepúcio junto a glande. Quanto ao exame intra-bucal apresentava grupo de múltiplas ulcerações na gengiva inserida superior, indolores e não percebidas pelo paciente.
Solicitado exames complementares: hemograma completo com contagem de plaquetas e teste anti-HIV, verificou-se que o hemograma, apresentava ligeira linfocitose e o teste anti-HIV foi positivo para HIV.
Tendo em vista a presença das lesões dermatológicas associadas as lesões genitais, nos foi permitido fazer um diagnóstico clinico de MC, diagnóstico esse reforçado pela condição de paciente HIV.
Discussão
O quadro clínico característico de MC na região supra hioidéia apresentado pelo paciente, associado ao órgão genital é patognomônico e clinicamente diagnóstico. Esse quadro está quase sempre associado a pacientes com doença pelo HIV, com comprometimento imunológico de mau prognóstico.
O paciente foi encaminhado ao CRT-AIDS ( Centro de Referência e Treinamento em Aids ) para tratamento médico.
É importante ressaltar que o diagnóstico de MC, bem como o de HIV, só foi possível graças ao detalhado exame clinico realizado.
Bibliografia
- ALDIGHIERI, F. C. & KOROLKOVAS, A . Aids e agentes retrovirais. Rev. Bras. De Medicina. v. 50, n° 6, p.593-601, 1993.
- BARRE-SINOUSSI, F., CHERMANN, J. C., REY, F. Isolation of a T-lympotropic retrovirus from a patient at risk for Acquired Immunodeficieny Syndrome. Science; 220: 868-70, 1983.
- BARTLETT, J. G. medical management of HIV infection. Physicians & scientists publishing, Illinois, 1996.
- BIRMAN, E. G. ; Aids. Rev APCD, v. 43 n° 5, Set 1989.
- CASTRO, B. G.; CARVALHO, E. A ; PEREIRA, H. G.; AIDS : Sindrome de imunodeficiência adquirida. Revista Ciência Hoje, vol 5, 1996.
- CEDROS – CADERNO DE SAÚDE BUCAL – AIDS. Manual sobre manifestações bucais e controle da infecção . Rede Cedro Rio de Janeiro pg. 21/ 1992.
- CENTER FOR DISEASE CONTROL AND PREVENTION. Case control Study of a HIV soroconvertion in health care workers after a percutaneous exposure to HIV infected blood. United Kingdom e United States, MMWR, 1995
- CURRAN, J. W., JAFFE, H. W. Epidemiology of HIV infection and AIDS in the United States. Science, 1988.
- FARLHERIG, CHARLES F; BROWN, SIMON E; STANGHTON, RICHARD. Atlas Colorido de AIDS e da doença HIV – 29 col. Artes Médicas SP pg. 50/ 1989.
- Gollheb, SL anel. Msykowski PL Molhuscum Contagiosum Int. 1 . Dermatology 33: 453 – 456, 1994.
- HELD FILHO, A & ALCÂNTARA, A O cirurgião Dentista frente à AIDS. Ed. Pancast, São Paulo, 1996.
- JACKSON, J. B. Detection and quantitation of human immunodeficiency virus type I using molecular DNA/RNA Tecnology. Arch Pathol Lab Med, 473-7, 1993.
- LIMA, A L. M.; KIEFFER, C. R. V. ; UIP. D. E. ; OLIVEIRA, M. G.; LEITE, O H. M. HIV/AIDS : Perguntas e respostas. Ed. Atheneu, São Paulo, 1996.
- MINISTÉRIO DA SAÚDE. Hepatites, AIDS e Herpes na Prática Odontológica – Brasilía pg. 27/ 1996.
- MYSKOWSKI, PAHICIA L AND. AHKAMI, ROSALME Dermatologie complication of HIV infection. The Medical Clinis of North América vol. 80, Number 6 pg. 1418-1419 nos 1996.
- OMS. AIDS 1. Editado OMS, Genebra, 1990.
- OMS. AIDS 2. Editado OMS, Genebra, 1990.
- ROSENBERG, Z. F., FAUCI, A S. The immunopathogenesis of HIV infection. Adv. Immunol., 356-431, 1989.
- SAMPAIO, S .A .P; CASTRO RM; RIVITTI, E.A . Dermatologia Básica 3a. Ed. Artes Médicas S. Paulo, Pg. 368-369/ 1985.
- Schwatrz 1.1. Aud Myskowski P.L. Molluscum Contagiosum in patients with human immuno – deficiency verus infections 1. Am. Acad. Dermatol. 27: 583 – 588/ 1992.
- VERRUSIO, A C.; NEIDLE, E. A ; NASH, K. D.; SILVERMAN, Jr; HOROWITZ, A M.; WAGNER, K.S. The dentist and infections diseases a national survey of attitudes and behavior. In JADA, 118 (5): 553-562, Chicago, 1989.
Myofibroma: A Rare Case Report of the Oral Cavity
 Loading...
Loading...
Nevo pigmentado no palato
RELATO DE CASO CLÍNICO
PROF. DR. ARTUR CERRI
Especialista, Mestre e Doutor em Semiologia pela USP
Prof. Titular da Disciplina de Semiologia da UNISA, UCCB e UNG
Prof. Adjunto de Semiologia da UMC
PROF. DR. SÉRGIO SPINELLI SILVA
Especialista, Mestre e Doutor em Semiologia pela USP
Prof. Titular da Disciplina de Semiologia da UMC
Prof. Adjunto da Disciplina de Semiologia da USP e UNG
PROF. PAULO JOSÉ BORDINI
Especialista, Mestre e Doutorando em Semiologia pela USP
Prof. Adjunto da Disciplina de Semiologia da UNISA, UCCB, UNG e UMC
PROF. CARLOS EDUARDO XAVIER DOS SANTOS RIBEIRO DA SILVA
Mestrando em Semiologia pela UCCB
Prof. Assistente da Disciplina de Semiologia da UCCB e UNG
PROF. FRANCISCO OCTÁVIO TEIXEIRA PACCA
Prof. Assistente da Disciplina de Semiologia da UCCB e UNG
UNITERMOS
Lesões névicas – Nevo – Nevus – Melanoma – Melanose
SINOPSE
Os autores relatam um caso clínico de nevo pigmentado localizado no palato duro de uma paciente de 23 anos. Discutem de forma sucinta a doença e procuram enfatizar o exame clinico objetivo.>
SUMMARY
The auyhors decribe a clinic case of nevus pigmented located in the hard palate of a 23 year old patient. They discuss briefly the illness and try to enphasize the objective clinic exam.
KEYWORDS
Nevus – Melanoma – Melanosis
INTRODUÇÃO
Etimologicamente nevo significa “marca de nascimento”, (2,7) o que nem sempre é verdadeiro pois geralmente essa alteração é evidenciada durante a infância (1,3)
Nevo ou nevus é uma malformação congênita de desenvolvimento (1,6), podendo ser observada na pele ( normalmente na bochecha ou na fronte ) ou em mucosas. É uma patologia rara de ser encontrada na mucosa bucal mas, quando ocorre sua área preferencial de localização é o palato, seguido da mucosa jugal, lábio e língua (2,3,6,8,9). Trata-se de uma lesão superficial que contém células névicas que ocorre com maior frequência na terceira e quarta décadas de vida, sendo o sexo feminino acometido duas vezes mais que o masculino (2,6).
Possui tamanho variável entre 1 e 30 mm, sendo sua lesão fundamental a mácula ou mais raramente a pápula, de coloração castanha, marrom, azul ou negra, que são circunscritas e bem delimitadas, de superfície lisa com consistência semelhante ao tecido de origem.
Histologicamente são reconhecidos diferentes tipos de nevos, conforme a localização das células névicas (1,2,3,4,6,9). O nevo juncional é o tipo mais raro que acomete a cavidade bucal e caracteriza-se pela proliferação de melanócitos na junção do epitélio com o tecido conjuntivo. Esse tipo possui uma considerável tendência a malignização. O nevo composto também raro na boca, apresenta-se como grupos de células névicas na área basal e focos de atividade juncional no epitélio adjacente. O nevo intramucoso é o tipo mais frequente na boca (1,6,8). A atividade juncional não existe e as células névicas agrupam-se na lâmina própria e submucosa, existindo uma faixa conjuntiva separando essas células do epitélio superficial. O nevo azul é o segundo tipo mais frequente, onde o epitélio não é afetado e aparece uma massa de células fusiformes contendo melanina no cório, além da presença de melanófagos ( macrófagos ).
O tratamento preconizado é a remoção cirúrgica, com margem de segurança para evitar-se que uma lesão com tendência a malignização fique exposta aos traumas agudos e crônicos inerentes a mucosa da cavidade bucal. É importante ressaltar que o material biopsiado deve ser obrigatoriamente analisado histologicamente, em vista do seu potencial de malignização.
CASO CLÍNICO
Paciente A.A.M.P., de 23 anos, sexo feminino, branca, brasileira, procurou a Disciplina de Semiologia, com queixa de possuir uma “pinta no céu da boca” ( sic ). A história odontológica demonstrou boas condições buco-dentais, com visitas periódicas ao Cirurgião-Dentista. Por ser professora e possuir um bom nível cultural, a paciente respondia de forma esclarecedora e objetiva a todas as perguntas formuladas pelo profissional.
Por ocasião da história da moléstia atual, a paciente relatou que há aproximadamente 5 anos, notou uma “pequena pinta” assintomática, no palato duro. Relatou ainda que não deu importância ao fato, uma vez que a alteração apresentada era assintomática. No entanto, resolveu procurar um especialista, tendo em vista o crescimento da alteração, particularmente nos últimos 30 dias. Em nenhum momento a paciente foi submetida a qualquer tipo de terapêutica.
Questionada sobre seus antecedentes médicos, relatou não apresentar problemas significativos de saúde presente e passado, apenas doenças próprias da infância. Seus pais são vivos e saudáveis (sic),além de não ter conhecimento de doenças em seus familiares diretos. Desconhecia também qualquer caso de neoplasia em familiares próximos.
Ao exame físico, no momento da consulta, apresentava uma pulsação de 80 b.p.m., pressão arterial de 120 por 70 mmHg e temperatura axilar de 36,3C.
O exame físico extra-bucal, revelou enfartamento ganglionar sub-mandibular móvel, indolor e superficial sugestivo de um quadro de hiperplasia linfóide benigna ( gânglio residual a patologias passadas ) A face apresentava-se simétrica com seu tegumento de textura, coloração e aspecto normais.
Ao exame físico intra-bucal ( fig. 1 ), verificou-se a presença de uma mancha caracterizada por “lesão névica”, localizada no terço médio e lateral do palato duro ( lado esquerdo ), de coloração marrom, formato oval, de superfície lisa, séssil, de bordas regulares e bem definidas e com aproximadamente 6 por 3 mm de área. Não foram observados ou constatados hábitos nocivos ou traumas sobre a lesão. Em vista do exposto, optamos por realizar a biópsia excisional no mesmo dia da consulta. Antes da cirurgia solicitamos o tempo de sangramento ( TS ), o tempo de coagulação ( TC ), hematócrito ( HT ) e hemoglobina ( HB ).
O resultado dos exames foram : TS – 2 minutos, TC – 6,3 minutos, HT – 44% e HB – 14G%, os quais estando dentro dos padrões de normalidade, não contra indicaram a realização da biópsia no mesmo dia da consulta.
Para a realização da biópsia utilizou-se como anestésico, 1,8 ml de Citanest, infiltrado à distância da lesão, para não interferir na análise histológica do espécime.
A incisão para a biópsia foi elíptica e em cunha, sendo que durante sua exérese, notou-se que a mesma encontrava-se infiltrada no tecido conjuntivo subjacente, o que nos levou a colocar o melanoma como hipótese de diagnóstico.
O material removido foi fixado em formol a 10% e encaminhado para exame histopatológico com diagnóstico clínico duvidoso entre nevo e melanoma.
Uma semana após o ato cirúrgico, o tecido encontrava-se parcialmente regenerado. O exame histológico, confirmou a hipótese de nevo intramucoso ( fig 2 ).
Após 14 dias da realização da biópsia o tecido encontrava-se todo regenerado, sendo recomendado o retorno da paciente após 3 meses para controle, onde verificou-se uma perfeita regeneração da fibromucosa palatina, sendo então dada alta para a paciente.
CONCLUSÕES
A análise e estudo do nevo pigmentado na cavidade bucal, nos permitiu chegar a algumas conclusões a saber :
– O nevo ou nevus pigmentado localizado intra-bucalmente é uma lesão relativamente incomum,
– O tipo de nevo intramucoso apresenta remotas possibilidades de degeneração maligna,
– As manchas localizadas na boca, especialmente as enegrecidas requerem por parte do C.D., uma maior preocupação, não afastando a possibilidade de sua remoção,
– O exame clinico detalhado e completo é fundamental na elaboração de hipótese diagnostica confiável.
REFERÊNCIAS BIBLIOGRÁFICAS
- Bhaskar, S.N. : Patologia bucal. Ed. Artes Médicas, São Paulo, S.P., 1976.
- Boraks, S. : Diagnóstico Bucal, Ed. Artes Médicas, São Paulo, S.P., 1996
- Cawson, R. A. : Enfermidades da boca : Correlações clínicas e patológicas. Ed. Artes Médicas, São Paulo, S.P.,1995
- Grinspan, D. : Enfermedades de la Boca. Editorial Mundi, Buenos Aires, 1973.
- Lawrance, C. M. & Cox, N. H. : Diagnóstico Clínico em Dermatologia. Ed. Artes Médicas, São Paulo, S. P., 1995
- Regezi, J.A. & Sciubba, J.J. : Patologia bucal. Ed. Guanabara-Koogan, Rio de Janeiro, R.J., 1991.
- Shafer,W.G. & Colabs. Tratado de Patologia Bucal. Ed. Interamericana, Rio de Janeiro. R.J. , 1985.
- Strassburg, M. & Knolle, G. : Diseases of the oral mucosa. Ed. Die Quintessenz, Berlin, Alemanha, 1972.
- Tommasi, A. F. : Diagnóstico em patologia bucal. Ed. Pancast Editorial, São Paulo , S.P., 1991.
O uso do levamisol na terapêutica das ulcerações aftosas recorrentes
CD ROSIENE DE FREITAS LIMA
Prof. Eduardo Ribeiro da Silva
Prof. Francisco Pacca
Prof. Artur Cerri
Características Clínicas
As UAR caracterizam-se por lesões ulceradas superficiais, de forma regular, única ou múltiplas, limites nítidos, halo eritematoso, leito fibrinoso branco-amarelado, podendo atingir até 1cm de diâmetro;
Recidivantes;
Dor intensa e linfoadenopatia do tipo inflamatório.
Características
As lesões aftosas são encontradas mais comumente na mucosa jugal, labial, na mucosa alveolar ou na superfície ventral da língua.
Regiões não queratinizadas.
Fatores Etiológicos
Agentes infecciosos
Pequenos traumas
Alterações hematológicas
Alterações hormonais
Hereditariedade
Autoimunidade
Fatores Psicogênicos
Classificação
Úlcera Aftosa Minor ou Afta Recorrente de Mikulicz & Kummel
Úlcera Aftosa Major ou Periadenite Mucosa Necrótica Recorrente de Sutton
Herpetiforme
DIAGNÓSTICO
Clínico
História Evolutiva do Quadro
Análise Histopatológica por Biópsia.
Terapêutica
Terapêutica Local: bochechos antissépticos (Clorexidina), anestésicos tópicos, tetraciclina tópica e corticosteróides de uso local.
Terapêutica Sistêmica: Benzodiazepínicos, Corticosteróides, Talidomida, controle hormonal e dietético.
LEVAMISOL
Levamisol é um antihelmíntico e agente imunomodulador
Renoux & Renoux (1971): primeiro a evidenciar seu efeito imunomodulador.
Restaurador da função de células imunodeficientes (fagócitos, linfócitos T e linfócitos B)
Dose adulto:
50 mg de 8 / 8 horas por 3 dias consecutivos, por 2 semanas.
50 mg por dia por 10 dias.
Dose Pediátrica:
3 mg / kg
Efeitos do Levamisol na UAR
Frequência e duração média dos surtos,
Severidades das aftas e conseqüentemente a sintomatologia dolorosa,
Número de aftas.
Principais Efeitos Colaterais
Cefaléia
Náuseas
Depressão
Diminuição da libido
Insônia
Paranóia
Xerostomia
Diarréia
CONCLUSÃO
O Levamisol mostra-se eficaz na terapêutica das Ulcerações Aftosas Recorrentes, diminuindo a freqüência, duração e severidade dos surtos
Osteonecrose dos maxilares induzido pelo uso de bifosfonatos, principais aspectos, diagnostico e protocolo de tratamento, revisão da literatura e relato de caso clinico
AUTORES:
Francisco Octavio Teixeira Pacca: Professor Doutor da Faculdade de Odontologia da APCD – FAOA, Mestre e Doutor em Diagnostico Bucal pela FOUSP, Especialista em Cirurgia e Traumatologia Buco Maxilo Facial pela ABMM, Chefe de Equipe do Serviço de Cirurgia Buco Maxilo Facial da AACD, Hospital Santa Catarina, Hospital Alemão Oswaldo Cruz e Hospital Israelita Albert Einstein.
Ruiter de Oliveira: Especializando em Cirurgia e Traumatologia Buco Maxilo Facial pelo SENAC: Membro de Equipe de Cirurgia Buco Maxilo Facial da AACD e Hospital Santa Catarina
Janaína Rocha da Costa: Especialista em Cirurgia Buco Maxilo Facial pela FOUSP: Membro de Equipe de Cirurgia Buco Maxilo Facial da AACD e Hospital Santa Catarina
Artur Cerri: Prof Titular da Faculdade de Odontologia da APCD – FAOA, Diretor da Escola de Aperfeiçoamento Profissional EAP – APCD; Especialista, Mestre e Doutor em Diagnostico Bucal pela FOUSP, Membro de Equipe de Cirurgia Buco Maxilo Facial da AACD
RESUMO:
Os bisfosfonatos fazem parte de um grupo de medicamentos utilizados no tratamento de pacientes com neoplasias malignas metastáticas relacionadas ao câncer de mama, próstata e mieloma múltiplo, incluindo outras doenças ósseas como osteoporose e doença de Paget. Elas inibem a reabsorção óssea induzindo apoptose. Apesar dos benefícios dos bifosfonatos, a osteonecrose dos maxilares emergiu como uma complicação grave em alguns pacientes tratados com estes fármacos, “a osteonecrose dos maxilares induzida pelo uso de bifosfonatos”. O presente trabalho tem como objetivo apresentar os principais aspectos clínicos, fatores etiológicos, prevenção e protocolo de tratamento atual com base na revisao da literatura.
Apresentação de um caso clinico de uma grave lesao em região mandibular associada ao uso de um fármaco da classe dos bifosfonatos, métodos utilizados para o diagnostico e tratamento proposto com ultilização de prototipagem e fixação interna rígida.
Palavra chave; Osteonecrose; Bisfosfonatos; Doença dos Maxilares; Protocolos Clínicos
ABSTRACT:
Introduction: Bisphosphonates are a group of medicines used to treat in patients with metastatic malignancies related to breast cancer, prostate cancer and multiple myeloma including another bone diseases osteoporosis and Paget disease. They inhibit bone resorption through action on osteoclasts slowing their activity and inducing apoptosis. Despite the benefits of biphosphonates, osteonecrosis of the jaws has emerged as a serious complication in some patients treated with these drugs, the osteonecrosis of the jaws induced by the use of bisphosphonates.
The present study aims to present the main clinical aspects, etiological factors, prevention and protocol of current treatment based on the review of the literature.
Presentation of a clinical case of a severe lesion in the mandibular region associated to the use of a bisphosphonate class, methods used for the diagnosis and treatment proposed with the use of prototyping and rigid internal fixation.
Key words: Osteonecrosis; Bisphosphonate; Clinical Protocols; Disease
INTRODUCAO:
Os bifosfonatos fazem parte de um grupo de medicamentos utilizados no tratamento de doenças malignas metastáticas relacionadas a câncer de mama, próstata e em outras doenças ósseas como osteoporose e doença de Paget. Seu mecanismo de ação reduz a reabsorção óssea, a inibição do recrutamento e promoção da apoptose de osteoclastos. Apesar dos grandes benefícios para pacientes nestas condições, uma complicação associada ao seu uso é a osteonecrose dos maxilares. Os pacientes com osteoporose, câncer e portadores de doenças metastáticas ósseas frequentemente apresentam complicações que incluem dor, fratura patológica, compressão da medula espinhal e hipercalcemia, que causam piora da qualidade de vida, grande morbidade e mortalidade¹. Essas alterações são normalmente consequência do processo de metástase, que é resultado da ativação de osteoclastos, mediado por diferentes citocinas produzidas pelas células tumorais, o que ocasiona a reabsorção óssea permitindo o crescimento tumoral².
Com o intuito de controlar essas complicações, nos últimos anos, a medicina vem utilizando medicamentos denominados bisfosfonatos (BFs), que são análogos dos pirofosfatos, não metabolizados, capazes de se depositarem no osso e inibir a função osteoclástica. Esses medicamentos fazem parte do protocolo de tratamento para pacientes com moderada a severa hipercalcemia associada com câncer; pacientes com lesões osteolíticas associadas ao câncer de mama e mieloma múltiplo em conjunto com quimioterapia antineoplásica e para lesões osteolíticas originárias de qualquer tumor sólido³,⁴
Isso resultou no acentuado uso dos bisfosfonatos na maior parte das clínicas e hospitais de oncologia médica no mundo. Inúmeros trabalhos clínicos têm evidenciado a eficácia dos BF´s na diminuição da lise óssea mediada por osteoclastos, redução da dor óssea e complicações esqueléticas. ¹,²,⁹
A partir de 2003, vários relatos de casos começaram a ser publicados na literatura a respeito de uma séria complicação possivelmente induzida pelos medicamentos da classe dos bifosfonatos: osteonecrose dos maxilares induzido pelo uso de bifosfonatos
A Associação Americana dos Cirurgiões Orais e Maxilofaciais definiu tal condição como: “tecido ósseo exposto na região maxilo facial que persiste por mais de oito semanas em pacientes em tratamento atual ou prévio com bifosfonatos, que não apresentam histórico de radioterapia de cabeça e pescoço”.
REVISÃO DE LITERATURA:
Os bifosfonatos são estruturalmente análogos ao pirofosfato, um produto normal do metabolismo humano que, quando sofre algumas modificações estruturais, dá origem a diferentes gerações de bifosfonatos com distintos níveis de atividade⁸. A primeira geração inclui o etidronato, a segunda representa os aminobisfosfonatos, como o alendronato e o pamidronato, e a terceira geração possui uma cadeia cíclica, sendo seus representantes o risedronato e o zoledronato⁷. As propriedades antirreabsortivas dos bifosfonatos aumentam, aproximadamente, dez vezes entre cada geração da droga⁷. Os bifosfonatos reduzem a reabsorção óssea de maneira dose dependente, principalmente ao inibirem o recrutamento e promoverem a apoptose dos osteoclastos, além de estimularem a atividade osteoblástica¹¹.
Os BF´s apresentam, basicamente, duas categorias de estrutura química da cadeia R2, que são os BF´s nitrogenados e os não-nitrogenados. Ambas são internalizadas pelos osteoclastos no processo de reabsorção óssea levando esta célula à morte por apoptose, por diferentes mecanismos de ação.
Os BF´s não-nitrogenados ao serem metabolizados pelos osteoclastos passam a ser substratos na síntese de análogos citotóxicos da adenosina trifosfato (ATP) que provocam a morte da célula. Contudo, os BF´s nitrogenados, após reabsorvidos pelos osteoclastos parecem atuar interrompendo a via do mevalonato, responsável por guiar a síntese do colesterol. A interrupção deste mecanismo faz com que o transporte vesicular intracelular seja comprometido, provocando a morte celular e afetando diretamente a reabsorção óssea¹².
Os BF´s podem ser administrados por via oral e endovenosa sendo bem distribuído pelo plasma e em parte cerca de 50% absorvido pelo osso sendo o restante excretado pelos rins sem modificação. Os BF´s acumulam-se por longos períodos dentro da matriz ósseas, dependendo do tratamento, duração e tipo de BF´s prescrito, o fármaco pode manter-se por vários anos no organismo²⁴.
Os BF´s comercializados no mercado brasileiro se diferem por sua forma de apresentação, marca comercial e indicação, conforme tabela 1.
CARACTERÍSTICAS DOS BFS DISPONÍVEIS NO MERCADO BRASILEIRO
| GENÉRICO | COMERCIAL | NITROGENADO | INDICAÇÃO | DOSE | POTENCIA | VIA ADM |
| Etidronato | Didronel | NÃO | Paget | 5 mg/Kg/dia400 mg/dia | 1x | Oral |
| Tiludronato | Skelid | NAO | Paget | 400 mg/dia | 1x | Oral |
| Clodronato | Bonefos | NAO | Neoplasia | 300 mg/dia IV | 10x | Oral |
| Pamidronato | Aredia | SIM | Paget Neoplasias | 60 mg | 100x | IV |
| Alendronato | Fosamax | SIM | Osteoporose Paget | Osteoporose 70 mg/sem. 10 mg/dia Paget 40 mg/dia por 6 meses | 500x | Oral |
| Ibandronato | Bondronat Boniva | SIM | Osteoporose | 150 mg/mês | 1000x | Oral |
| Risedronato | Actonel | SIM | Osteoporose | 35 mg/sem.5 mg/dia | 2000x | Oral |
| Zoledronato | Zometa Aclasta | SIM | Paget / Neoplasia | 5 mg Dose única | 10.000x | IV |
DIAGNOSTICO, CARACTERÍSTICAS CLINICAS E TRATAMENTO
O diagnostico e basicamente feito através de anamnese e exame clínico do paciente, vários sinais e sintomas precedem suas manifestações clínicas, destacando- -se dor, mobilidade dentária, edema na mucosa, eritema, ulceração e, quando envolve a maxila, há presença de sinusite crônica. Pode ocorrer espontaneamente ou numa região prévia a cirurgias dentárias.
A osteonecrose associada ao bifosfonato (OAB) pode se mostrar assintomática por semanas, meses e anos, mas pode resultar em dor ou exposição do osso mandibular ou maxilar, quando localizadas nas proximidades de lesões ulceradas ou infectadas²⁵,²⁶.
Exames auxiliares podem ser solicitados para elucidação do diagnostico tais como radiografia panorâmica onde o aspecto radiográfico da OAB pode ser definido como uma esclerose óssea difusa, presença de sequestro ósseo, reação periosteal e fístula oro antral, assim como manchas radiolúcidas difusas e lesões osteolíticas com envolvimento de cortical óssea²⁷. Ao exame tomográfico observa-se uma imagem mais detalhada podendo ajudar no diagnóstico diferencial entre osteonecrose dos maxilares e doença óssea metastática. Pode haver reabsorção do trabeculado ósseo com alteração da sua estrutura, isto dependerá muito do tamanho e intensidade do processo de OAB²⁸.
Já outro exame que pode ser utilizado, porém com caráter preventivo, é o teste Telopeptídeo carboxiterminal do colágeno tipo I (CTX), recomendado para avaliar o risco de osteonecrose naqueles pacientes utilizando bifosfonatos por mais de três anos, sendo ideais os níveis maiores do que 150 pg / mL para a realização de qualquer tipo de operação com o mínimo risco e sem a necessidade de suspender medicação e, quando estes forem inferiores a 150 pg / mL, a medicação deve parar por um período de entre quatro e seis meses ou outra opção de tratamento protético deve ser preferível²⁹.
Segundo publicação de Assael (2009), os níveis da OAB , são classificados de acordo com seus respectivos estágios, conforme tabela 2.
| ESTÁGIOS | CARACTERÍSTICAS |
| ESTAGIO 0 | Sinais e sintomas brandos com pequena quantidade de osso necrótico em histologia ou osso pré necrótico |
| ESTAGIO 1 | Osso necrótico exposto, porém com ausência de infecção e ausência de sintomatologia |
| ESTAGIO 2 | Osso necrótico exposto com presença de infeção e sintomatologia |
| ESTAGIO 3 | Osso necrótico exposto, dor, infeção, ou outros acometimentos: fratura patológica, extensão até basilar e fístula extraoral. |
Assael (2009)
Segundo Souza et al em 2009, conforme publicação em sua revisão, a associação entre a OAB é conclusiva porém um protocolo de tratamento ainda é amplamente discutido por envolver desde antibioticoterapia sistêmica, debridamento e ou resseccao dos tecidos envolvidos, terapia hiperbárica, e cirurgia microvascularizada, conforme tabela 3.
| AUTORES | CASOS | FÁRMACOS | TRAT. PROPOSTO |
| Dimopoulos et al. (2006) | 15 | Zoledronato, Pamidronato, Residronato, Clondronato, Ibandronato | Antibioticoterapia, Debridamento, Higiene Oral cuidadosa, Oxigenoterapia hiperbárica |
| Dimitrakopoulos et al. (2006) | 11 | Zoledronato, Pamidronato, Ibandronato | Antibioticoterapia, Debridamento, Sequestrectomia, Oxigenoterapia hiperbárica |
| Bagan et al. (2006) | 20 | Zoledronato, Pamidronato | Antibioticoterapia, Cirurgias orais menores, Ressecção óssea, Cirurgia microvascularizada |
| Migliorati et al. (2005 | 18 | Zoledronato, Pamidronato | Sequestrectomia, Analgésicos, Antibioticoterapia, Terapia Hiperbárica, Curetagem |
RELATO DE CASO:
Paciente, 75 anos de idade, gênero feminino, procurou atendimento odontológico relatando dor e desconforto em região mandibular e dificuldade de alimentar-se, portadora de prótese total superior e inferior, relata inicio do processo há cerca de um ano, ao exame clínico além de forte halitose, observa-se áreas de tecido ósseo necrótico exposto em todo o rebordo alveolar inferior associado a fratura completa em região de sínfise, (figura 1) paciente relatou história de câncer de mama, tratamento cirúrgico associado a radioterapia e quimioterapia por via endovenosa, em uso de Zometa há 6 anos.
Ao exame radiográfico observa-se extensa lesão osteolítica em rebordo alveolar e fratura em região de sinfese com deslocamento dos cotos (figura 2 3). O tratamento proposto foi debridamento do osso necrótico mais ressecção dos cotos com margem de segurança, instalação de placa reconstrutiva previamente moldada em modelo de prototipagem, (figuras 4, 5 e 6), procedimento realizado em ambiente hospitalar sob anestesia geral.
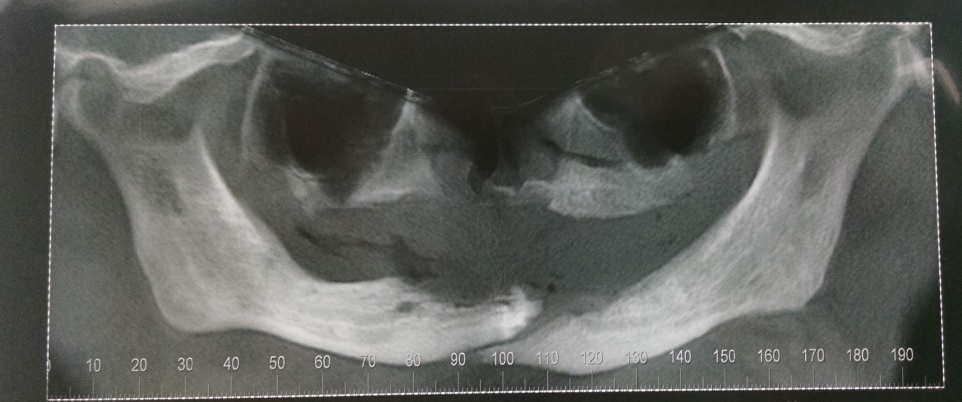
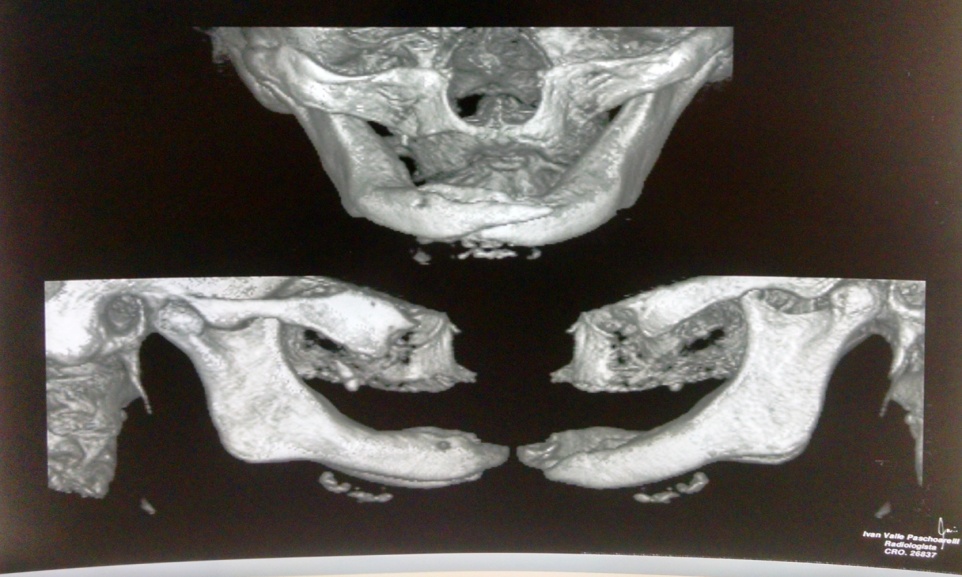
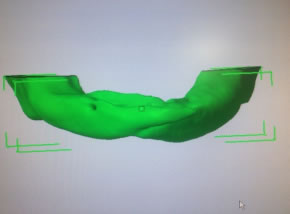
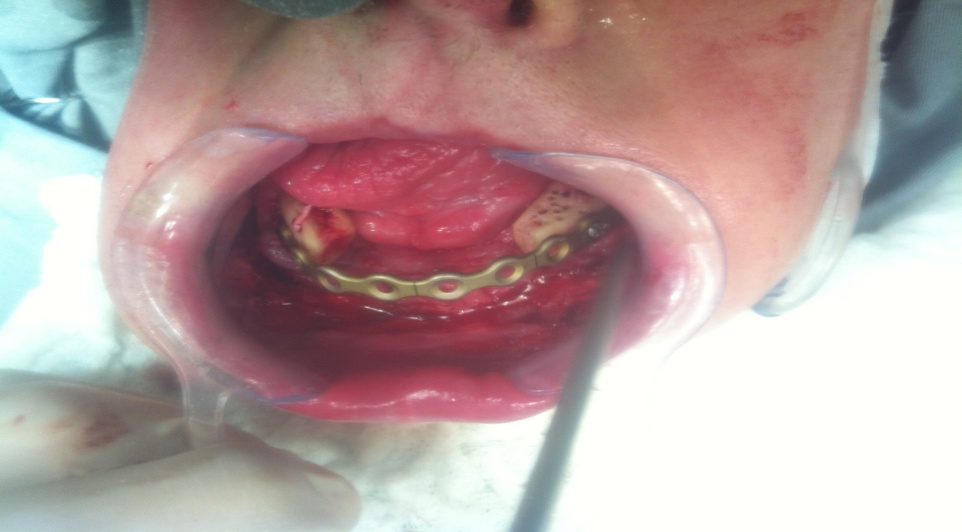
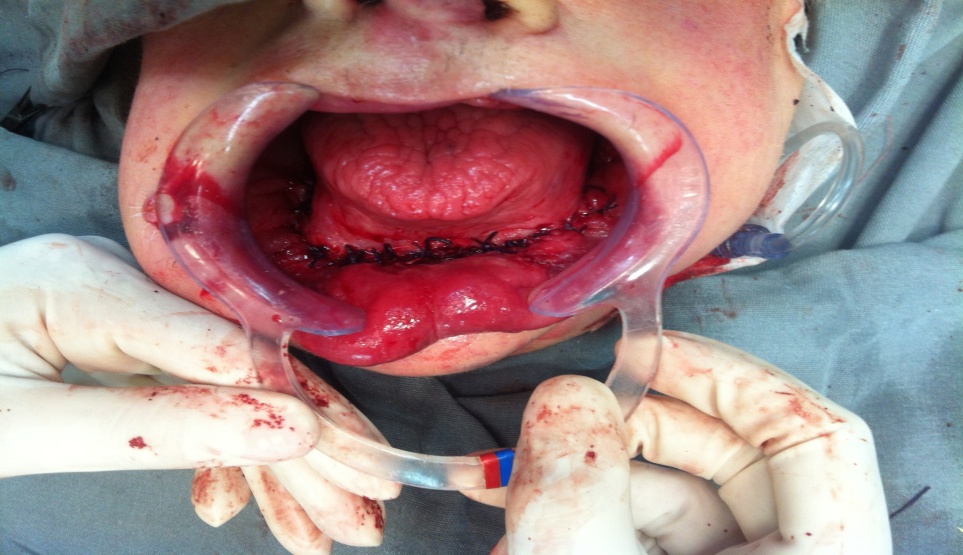
DISCUSSÃO:
Segundo a American Association of Oral and Maxillofacial Surgery, a OAB deve apresentar os seguintes critérios de inclusão17:
- Tratamento prévio ou atual com bifosfonatos;
- Osso necrótico exposto na região maxilofacial, que persiste por um período superior a oito semanas;
- Inexistência de história prévia de radioterapia na região dos maxilares.
As lesões de osteonecrose induzida por bifosfonatos surgem, geralmente, como ulcerações na mucosa com exposição óssea subjacente e com dor associada, embora num 1/3 seja indolor18. Apresentam localização predominante na mandíbula, embora também existam relatos de casos na maxila e no palato19. Esta localização preferencial parece estar relacionada com as características anatômicas e fisiológicas da mandíbula, designadamente a sua menor vascularização, bem como o carácter terminal da artéria mandibular. Estas lesões não cicatrizam num período de seis a oito semanas, tornando-se persistentes, não reagindo aos tratamentos convencionais20. A OAB tem como fatores desencadeantes mais comuns a exodontia e o trauma iatrogênico, embora possam ocorrer espontaneamente20. A incapacidade do osso hipodinâmico e hipovascularizado para compensar a necessidade de reparação e remodelação óssea decorrentes de stress fisiológico (mastigação), trauma iatrogênico (prótese mal adaptada), procedimentos cirúrgicos ou infecções de origem dentária, têm contribuído para o aparecimento das lesoes21, 22. A existência de fatores predisponentes, como a utilização de fármacos com propriedades anti-angiogênicas (glicocorticoides, talidomida) ou de diabetes mellitus e doença vascular periférica, fazem destas situações fatores de risco sistêmico 22.
A OAB causada por fármacos administrados por via oral difere significativamente quando associada à forma intravenosa, em três formas principais: os doentes que tomam bifosfonatos orais requerem um longo período de terapia antes de indícios de osso exposto; manifestam uma menor exposição do osso e os sintomas são menos severos e tem a chance de melhorar os sintomas ou exposição após suspensão das drogas, gerando uma cicatrização óssea23.
CONCLUSÃO:
Com efeito, dadas as sérias complicações associadas ao complexo maxilo-facial, é imprescindível que todo o tratamento com bifosfonatos, particularmente em doentes com mieloma múltiplo e tumores sólidos seja precedido de uma consulta por um cirurgião dentista, visando a adoção de medidas preventivas, designadamente:
- Consultas frequentes ao cirurgião-dentista para avaliação das condições orais, controle de higiene, aplicação de flúor, monitoramento radiográfico, adaptação de próteses (a cada seis meses);
- Estabilização das doenças da cavidade oral;
- Evitar atos cirúrgicos na cavidade oral (exodontias, colocação de implantes, etc, após inicio da terapia com bifosfonatos);
- Quando for necessário procedimento invasivo na boca, o caso deve ser discutido entre o oncologista e o cirurgião-dentista.
- Monitoramento do tecido ósseo através do nível do CTX Plasmático.
- Esclarecimento do paciente quanto aos fatores de risco para o desenvolvimento da osteonecrose
Tais medidas possibilitará ao profissional uma análise mais correta dos casos, a fim de diminuir possíveis riscos de desenvolvimento da lesão e ou o estadiamento da mesma, bem como a definição de metodologia de abordagem multidisciplinar dos doentes com o intuito otimizar os diferentes tipos de tratamento, os respectivos prognósticos e a qualidade de vida.
REFERENCIAS:
| 1. Hortobagyi GN, Theriault RL, Lipton A, Porter L, Blayney D, Sinoff C, et al. Long-term prevention of skeletal complications of metastatic breast cancer with pamidronate. Protocol 19 Aredia Breast Cancer Study Group. J Clin Oncol. 1998;16(6):2038-44. | 2. Conte PF, Giannessi PG, Latreille J, Mauriac L, Koliren L, Calabresi F, et al. Delayed progression of bone metastases with pamidronate therapy in breast cancer patients: a randomized, multicenter phase III trial. Ann Oncol. 1994;5 Suppl 7:S41-4. |
| 3. Hillner BE, Ingle JN, Berenson JR, Janjan NA, Albain KS, Lipton A, et al. American Society of Clinical Oncology guideline on the role of bisphosphonates in breast cancer. American Society of | 4. Berenson JR, Hillner BE, Kyle RA, Anderson K, Lipton A, et al. American Society of Clinical Oncology clinical practice guidelines: the role of bisphosphonates in multiple myeloma. J Clin Oncol. 2002;20(17):3719-36. |
| 5. van Holten-Verzantvoort AT, Kroon HM, Bijvoet OL, Cleton FJ, Beex LV, Blijham G, et al. Palliative pamidronate treatment in patients with bone metastases from breast cancer. J Clin Oncol. 1993;11(3):491-8 | 6. Greensberg MS. Intravenous bisphosphonates and osteonecrosis. Oral Med Pral Pathol Oral Radiol Endod 2004;98:259-60. |
| 7 . Tenenbaum HC, Shelemay A, Girard B, Zohar R, Fritz PC. Bisphosphonates and periodontics: potential applications for regulation of bone mass in the periodontium and other therapeutic/diagnosis uses. J Periodontol. 2002;73:813-22. | 8 .Wong R, Wiffen PJ. Bisphosphonates for the relief of pain secondary to bone metastases [Cochrane Review]. Cochrane Database Syst Rev. 2004;(2). |
| 9. Theriault RL, Lipton A, Hortobagyi GN, Leff R, Glück S, Stewart JF, et al. Pamidronate reduces skeletal morbidity in women with advanced breast cancer and lytic bone lesions: a randomized, placebo-controlled trial. Protocol 18 Aredia Breast Cancer Study | 10. Pavlakis N, Stockler M. Bisphosphonates for breast cancer [Cochrane review]. Cochrane Database Syst Rev. 2004;(2). |
| 11. Rang HP, Dale MM, Ritter JM, Moore PK. Farmacologia. 5a ed. Rio de Janeiro: Elsevier; 2004. | 12. Wang HL, Weber D, McCauley LK. Effect of long-term oral bisphosphonates on implant wound healing: literature review and a case report. J Periodontol 2007; 78:584-594. |
| 13. Castro LF, Ferreira AG, Ferreira EI. Bifosfonatos como transportadores osteotrópicos no planejamento de fármacos dirigidos; Quim. Nova, 2004; 27:456-460. | 14.Devogelaer JP. Clinical use of bisphosphonates. Curr Opin Rheumatol |
| 15. Dao TT, Anderson JD, Zarb GA. Is osteoporosis a risk factor for osseointegration of dental implants? Int J Oral Maxillofac Implants 1993; 8:137-144. | 16- Migliorati CA, Casiglia J, Epstein J, Jacobsen PL, Siegel M, Woo SB. Managing the care of patients with bisphosphonate-associated osteonecrosis An American Academy of Oral Medicine position paper. J Am Dent Assoc 2006; 136(12):1658-1668. |
| 17- AAOMS Position Paper: American Association of Oral and Maxillofacial Surgeons Position Paper on Bisphosphonate-Related Osteonecrosis of the Jaws. J Oral Maxillofac Surg 2007;65:369-376 | 18 – MARX RE, SAWATARI Y, FORTIN M, BROUMAND V: Bisphosphonates-Induced Exposed Bone (Osteonecrosis/Osteopetrosis) of the Jaws: Risk Factors, Recognition, Prevention and Treatment.J Oral Maxillofac Surg 2005;63:1567-75 |
| 19 – WOO SB, HELLSTEIN JW, KALMAR JR: Systematic review: Bisphosphonates and Osteonecrosis of the Jaws. Ann Intern Med 2006;144:753-761 | 20 – 4. FRESCO RE, FERNÁNDEZ NP, URIZAR JMA: Bisphosphonates and Oral Pathology II. Osteonecrosis of the jaws: Review of the literature before 2005. Med Oral Patol Cir Bucal 2006;11:E456-61 |
| 21 – 16. MIGLIORATI CA; SCHUBERT MM, PETERSON DE, SENEDA LM: Bisphosphonate-Associated of Mandibular and Maxillary Bone. An Emerging Oral Complication of Supportive Cancer Therapy. Cancer 2005;104(1):83-93 | 22 – 18. KHAMAISI M, REGEV E, YAROM N et al: Possible Association Between Diabetes and Bisphosphonates-related Jaw Osteonecrosis. J Clin Endocrinol Metab 2007;92(3):1172-5 |
| 23 . Marx RE, Cillo JEJ, Ulloa JJ. Oral bisphosphonate-induced osteonecrosis: risk factors, prediction of risk using serum CTX testing, prevention, and treatment. J. oral maxillofac. surg. 2007;65:2397-410. | 25. Harper RP, Fung E. Resolution of bisphosphonate-associated osteonecrosis of mandible: possible application for intermittent low-dose parathyroid hormone. J Oral Maxillofac Surg. 2007;65(3):573-80. |
| 26. Ruggiero SL, Mehrotra B. Bisphosphonates-related osteonecrosis of the jaw: diagnosis, prevention, and management. Annu Rev Med. 2009;60:85-96 | 27. Ruggiero SL, Dodson TB, Rosenberg TJ, Engroff SL. Osteonecrosis of the jaws associated with the use of bisphosphonates: a review of 63 cases. J Oral Maxillofac Surg 2004; 62(5): 527-34. |
| 28. Bianchi SD, ScolettaM, Cassione FB, MigliarettiG, Mozzati M. Computerized tomographic findings in bisphosphonate-associated osteonecrosis of the jaw in patients with cancer. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007; 102(2): 249-58 | 29.Marx RE, Cillo JEJ, Ulloa JJ. Oral bisphosphonate-induced osteonecrosis: risk factors, prediction of risk using serum CTX testing, prevention, and treatment. J. oral maxillofac. surg. 2007;65:2397-410. |
Prevalence of human papillomavirus in squamous cell carcinoma of the tongue
- Carlos Eduardo Xavier dos Santos Ribeiro da Silva
- Ismael Dale Cotrim Guerreiro da Silva
- Artur Cerri
- Luc Louis Maurice Weckx Oral Surgery
- Oral Medicine
- Oral Pathology
- Oral Radiology and Endodontics
- October 2007 (Vol. 104, Issue 4, Pages 497-500)


ABSTRACT
Oncogenic human papillomaviruses (HPVs) are important agents in the genesis of gynecological cancer, and have also been implied in the genesis of oral cancer. With the purpose of evaluating the relation between HPV and squamous cell carcinoma (SCC) of the tongue a case-control study was performed. 50 Caucasian male patients who were smokers and had the histological diagnosis of SCC of the tongue were selected. The control group was comprised of 10 matched patients with no clinical evidence of tongue lesions. Polymerase chain reaction (PCR) was used to detect the presence of HPV genome in fresh-frozen tissue specimens from SCC of the tongue margin. Thirty seven patients (74%) had a positive PCR for oncogenic papillomavirus, and only one specimen (10%) of the control group was positive for non-oncogenic papillomavirus. Based on the statistical analysis of this study there was a 25.6 higher risk for SCC of the tongue to harbor oncogenic HPV than the healthy control tongur tissue.
INTRODUCTION
Human papillomavirus (HPV) is a virus of the Papillomavirus genus, of the Papovaviridae family, with more than 120 subtypes identified up to the moment, and is composed of a genome of 8000 base pairs of double-stranded DNA forming a complex similar to a chromosome encased by a 55nm non-enveloped outer capsid protein.1 The cleavage site of viral DNA circular molecules is specific, that is, it is always cleaved at the same site between E1 and E2 genes. E2 is responsible for repressing transcription of the E6 and E7 viral genes. Once E2 is inactivated by cleavage of the viral molecule, a dysregulated expression of the E6 and E7 genes occurs.1
The oncogenic potential of the HPV is related to gene products that interact and inactivate cell proteins derived from suppressor genes of p53 and p105-RB and promote degradation of these genes, thus blocking their function. Oncogenicity, among other conditions, will depend directly on the degree of affinity between proteins derived from tumor suppressor genes and viral proteins derived from the E6 and E7 genes. 1 Thus, “high risk� E6 and E7 gene products have a high affinity for p53 and p105-RB derived proteins, whereas “low risk� viral gene derived products have a low affinity for these proteins. The result of viral penetration is the immortalization of cells in which HPV had integrated. These cells morphologically exhibit abnormal mitosis, nuclear pleomorphism, aneuploid DNA content consistent with abnormal chromosome number, and chromosome architectural changes.1 However, these cells only start to generate tumors when the E6 and E7 transforming genes are exposed to activated cell oncogenes1. However, HPV may not operate alone in oncogenesis. In theory, other factors such as the host’s immune status, nutritional deficiency, and cigarette and alcohol consumption operate together favoring and potentializing tumor onset. The association of these factors with oncogenic HPV subtypes is extremely important in the genesis of malignant tumors, since cigarette and alcohol operate as inducing factors and papillomavirus operates in the tumor progression phase.
In fact, recent evidence suggests that HPV can be present in up to 100% of patients with cervical carcinoma.2 The different types of HPV are divided into two groups depending on their oncogenic potential. HPVs considered non-oncogenic are the 6, 11, 42 and 54 subtypes, usually present in verrucous lesions, papillomas and condylomas.3 The oncogenic subtypes are the 16, 18, 31, 33, 35, 39, 45, 51, 55, 56, 58, 66, and 68, which are frequently found in patients with malignant neoplasms.3,4 The mere presence of oncogenic HPV may increase the relative potential for the development of cervical intraepithelial neoplasm by up to 116 times.5 The Word Health Organization considers HPV a carcinogen. Oral cavity cancer is a major cause of mortality and morbidity in Brazil. According to INCA (Brazilian National Cancer Institute)6 data, the estimated incidence of new cases for 2005 ranks it as the eighth most frequent type of cancer in males and ninth in females, with 9985 and 3895 cases, respectively. The most prevalent type of cancer of the oral cavity is the squamous cell carcinoma (SCC) accounting for approximately 95% of all malignant neoplasms of this site. The principal risk factors for oral cancer are smoking, excessive alcohol consumption, and exposure to sun radiation (for neoplasm of the lower lip).
Some authors have associated the presence of HPV, particularly of type 16 as factors contributing to the onset of squamous cell carcinoma (SCC) of the ororpharynx, but its role in oral cavity cancer is controversal.7,8 and 4 The prevalence of HPV in oral cavity cancer has been variable in the literature, mainly due to variations in site and mixture with oropharynx sample size, population studied and sensitivity of the techniques used. The previous results were very debatable and we believed that the methods used in previous research were inadequate. Such studies have used in situ hybridization and the hybrid capture as HPV detection methods, and such methods are substantially less sensitive than PCR. Besides, while the fresh-frozen tissue has a higher preservation rate of viral DNA, many studies have used material from paraffin blocks. A study conducted in 1996 demonstrated that the presence of HPV is more frequent when the sample is tested by PCR (37,1%) than when tested by in situ hybridization (16,9%) and that it is also more frequent when frozen oral tissue is tested (51,6%) than when paraffin-embedded tissue is (21,7%).9Â A meta-analysis of 4680 samples of oral SCC has come to the conclusion that the presence of HPV is more frequent in carcinomatous epithelium and is an independent significant risk factor for oral SCC.10 The objective of the present study is to evaluate the presence of human papillomavirus (HPV) genome both oncogenic and non-oncogenic types in fresh tissue specimens from oral tongue SCC, using polymerase chain reaction (PCR), and to compare these results with those obtained in tissue specimens of a similar site removed a control group of cancer-free individuals.
METHODS
Sixty fresh tissue specimens from the oral tongue were used in this study. Fifty were from patients with squamous cell carcinoma (SCC) of the oral tongue and 10 were from volunteers ( from the hospital staff ) of the control group who had no clinical evidence of disease. and no one had history of cancer The patients were selected at the Outpatient Service of Oral Medicine, of the Federal University of Sao Paulo – UNIFESP, and at the Oupatient Service of the Discipline of Oral Medicine of the Santo Amaro University – UNISA. The material was collected only after approval of the Research Ethics Committees of both UNIFESP and UNISA. All of those patients readied and signed the informed consent.
All subjects participating in the study were males, older than 40 years, Caucasian and smokers. These criteria were used because they are statistically related to the group with a higher incidence of oral cavity cancer according to the Brazilian National Cancer Institute.6 We performed anesthesia followed by incisional biopsy of the lesion, from which a small fragment of tissue was removed using a number-5 biopsy punch (diameter of approximately 5.0mm). For patients with no clinical signs of disease (control group), a small amount of anesthetic agent was infiltrated in the lateral oral tongue, and the tissue was removed with a number-2 biopsy punch (diameter of 2.00 mm).
The tissue removed with a diagnostic hypothesis of SCC was divided into two fragments, one of which was immersed in 10% formalin for pathological examination to confirm the diagnosis, and the other was immersed in an Eppendorf tube with 0.9% saline solution and frozen at minus 20ºC in the Laboratory of Molecular Gynecology of UNIFESP. A similar method was used for the control group. For the SCC group, all patients had squamous cell carcinoma confirmed by histopathological examination.
The “Phenol-Chloroformâ€? protocol for DNA extraction was used for the 60 fresh frozen specimens collected (50 in the SCC group and 10 in the control group). For polymerase chain reaction (PCR), a commercial kit for the detection of HPV (BIOPAP kIT) was used. BIOPAP KIT is manufacturated by Biotools B & M Labs S.A. – Madrid, Spain. According to the manufacturer this kit is able to detect the presence of HPV and separate it into two groups named oncogenic – 16, 18, 31, 33, 35, 52, 58 and 67 and non-oncogenic – 6, 11, 13, 16, 18, 30, 31, 32, 33, 34, 35, 39, 40, 42, 43, 44, 51, 52, 53, 54, 55, 56, 57, 58, 59, 61, 62, 64, 66, 67, 68 and 69   (manufacture’s nomenclature) according to its oncogenic potential. It needs only 10 copies of the HPV DNA to be positive. For each assay a negative control (DNA replaced by water) and another molecular weight marker were amplified in addition to the specimens and the positive control included in the commercial kit was performed to certificate the method. The visualization of the bands under ultraviolet transillumination enabled determining the presence or absence of HPV DNA in the specimens. In the cases where the reaction was positive thanks to the difference in the number of base pairs between the “oncogenicâ€? (250bp) and the “non-oncogenicâ€? (450 bp) groups, the classification of the specimens in one of these groups was also possible.
The Fisher’s exact test was used to evaluate whether the presence of HPV was associated with oral cancer. To quantify this association, the odds ratio was estimated whenever possible, that is, the likelihood of a patient with HPV to have oral cavity cancer when compared to a patient without HPV using a univariate logistic regression model. The response variable in this model was the presence of cancer (yes or no), and the explanatory variable was the presence of HPV (yes or no).
RESULTS
Of the 50 specimens of squamous cell carcinoma of the lateral oral tongue analyzed by polymerase chain reaction (PCR) to detect human papillomavirus DNA, 37 (74%) were positive for the “oncogenic� subtypes. None of the specimens (0%) was exclusively positive for “non-oncogenic� subtypes. Of the 10 specimens of normal tissue from the control group analyzed with this method, only one (10%) was positive for “non-oncogenic� subtypes and no specimens (0%) were positive for “oncogenic� subtypes.
The prevalence of HPV was not similar in the two groups (p≤0.01). Logistic regression model analysis demonstrate that patients with SCC of the tongue had 25.6 higher odds (95%CI = 3.0 – 222.2) of having oncogenic HPV than the controls. Since none of the patients without oral cancer had oncogenic HPV, estimates using the logistic regression model for odds ratio could not be obtained.Â
DISCUSSION
An interesting study has demonstrated the presence of HPV 16 in 69.2% of oral SCC cases and of HPV 18 in 28% of them by utilizing a combination of PCR with in situ hybridization and has shown also that the same samples tested negative when tested with isolated hybridization11. In our study we have used two groups with different numbers of individuals, being 50 with tongue SCC and 10 without the disease, following the orientation of the Research Ethics Committee – regarding biopsy in patients with no evidence of disease. Despite the different sizes of the material collected in the biopsies (5 mm for SCC cases and 2 mm for the control group), the material used in the PCR had practically the same size, for the fragments of the SCC cases were cut in half to allow the histopathological analysis. We observed that out of a total of 50 specimens of squamous cell carcinoma removed from the lateral oral tongue, 74% were positive for oncogenic subtypes of HPV. These results are similar to those obtained by other authors: 78%12;72.5%;13 72.5%14; 91%15, and 74%16. These results suggest that oncogenic HPV should be considered as a risk factor for oral tongue cancer.
On the other hand, our results are not in agreement with those obtained by several authors such as Chang et al. (1990) who found HPV in 27.5%17 of the oral cavity SCC specimens analyzed; and other authors in 8.4%18; 31%19; 12.5%20 and 42%21. The discrepancy of results is attributed to the fact that in most cases in which the prevalence of HPV was low, a viral DNA amplification from paraffin blocks was performed, whereas in the studies where the prevalence of HPV was higher, like in ours, the DNA was amplified from fresh tissue (frozen immediately after biopsy). The material is usually fixed in 10% formalin prior to being embedded in a paraffin block. Formalin fixation, paraffin embedding, and subsequent deparaffinization can lead to degradation of viral DNA making its detection impossible or difficult9. Secondly, the high-sensitivity and specificity BIOPAP kit (Spain) was used for this study. This kit has the property to detect the presence of HPV genome and to discriminate its potential into the oncogenic and non-oncogenic groups.
Of the 10 specimens of the control group which presented a clinically normal mucosa, only one (10%) was positive for the non-oncogenic subtype, and none of the specimens was positive for oncogenic subtypes. In this sense, our study corroborates many other studies conducted by this authors with 0%14; 11.1%22; and 0%20. Chang et al17. (1990) analyzed 40 specimens of normal tissue and found no evidence of HPV. Based on our findings and on the analysis of other authors’ studies we believe that the tongue is the not the only place in the mouth where oncogenic HPV can be found and we believe that other places in the mouth may have the SCC risk increased by the presence of HPV.
CONCLUSIONS
The study conducted with fresh-frozen specimens of oral tongue squamous cell carcinoma using PCR allowed us to conclude that oncogenic human papillomavirus is present in 74% of cases, whereas the control group had a prevalence of none (only 10% non-oncogenic). These rates suggest that oral cavity cancer HPV positive rates may be higher than previously suspected. More studies are needed to know if the simple presence of HPV in oral cavity can increase the risk of oral cancer.
KEYWORDS: Papillomavirus, Mouth Neoplasms, Head and Neck Neoplasms, Oncogenic viruses, Polymerase Chain Reaction
REFERENCES
1. Syrjanen K, Syrjanen S, Lamberg M, Pyrhonen S, Nuutinen J. Morphological and immunohistochemical evidence suggesting human papillomavirus (HPV) involvement in oral squamous cell carcinogenesis. Int J Oral Surg 1983;dec;12(6):418-24.
2. zur Hausen H. Papillomavirus causing cancer: evasion from host-cell control in early events in carcinogenesis. J Natl Cancer Inst. 2000; 92(9), 690-8.
3. Villa LL. Human papillomavirus and cervical cancer. Advanc Canc Res. V.71, p.321-341, 1997
4. Watts SL; Brewer EE; Fry TL. Human papillomavirus types in squamous cell carcinomas of the head and neck. Oral Surg Oral Med Oral Pathol; 71(6):701-7, 1991 Jun.
5. Rozendal AL, Walboomers JMM, van der Linden JC, Voorhost FJ, Kenemans P, Helmerhost TJM, Ballegooijen M. PCR based high-risk HPV test in cervical cancer screening gives objective risk assessment of women with cytomorphologically normal cervical smears. Int J Cancer; v.68, p.766-9, 1996.
6. Brazilian National Cancer Institute www.inca.gov.br/cancer. Access in 15/04/2006.
7. Gillison, ML et al. Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. Journal of the National Cancer Institute 2000;92(9):709-20.
8. Mineta H, Ogino T, Amano HM, Ohkawa Y, Araki K, Takebayashi S, Miura K. Human papilloma virus (HPV) type 16 and 18 detected in head and neck squamous cell carcinoma. Anticancer Res 1998;nov-dec;18(6B):4765-8.
9. Miller CS, White DK. Human papillomavirus expression in oral mucosa, premalignant conditions, and squamous cell carcinoma: a retrospective review of the literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1997 Feb;83(2):187-8
10. Miller CS; Johnstone BM. Human papillomavirus as a risk for oral squamous cell carcinoma: a meta-analysis, 1982-1997. Oral Surg Oral Med Oral Pathol Oral Radiol Endod; 91(6):622-35, 2001 Jun.
11. Miller CS; Zeuss MS; White DK. Detection of HPV DNA in oral carcinoma using polymerase chain reaction toguether with in situ hybridization. Oral Surg Oral Med Oral Pathol; 77(5):480-6, 1994 May
12. Woods KV, Shillitoe EJ, Spitz MR, Schantz SP, Adler-Storthz K. Analysis of human papillomavirus DNA in oral squamous cell carcinomas. J Oral Pathol Med 1993;mar;22(3):101-8.
13. Nielsen H, Norrild B, Vedofte P. Human papillomavirus in oral premalignant lesions. Eur j Cancer B Oral Oncol 1996;(32):264-70.
14. Cao J, Zhang ZY, Zhang YX. Human papillomavirus infection and p 53 alteration in oral squamous cell carcinoma. Chin Dent Res 2000;nov;3(3):44-9.
15. Bouda M, Gorgoulis VG, Kastrinakis NG, Giannoudis A, Tsoli E, Danassi-Afentaki D, et al. “High risk” HPV types are frequently detected in potentially malignant and malignant oral lesions, but not in normal oral mucosa. Mod Pathol 2000;jun;13(6):644-53.
16. Balaram P, Nalinakumari KR, Abraham E, Balan A, Hareendran NK, Bernard HU, Chan SY. Human papillomaviruses in 91 oral cancers from Indian betel quid chewers-high prevalence and multiplicity of infections. Int J Cancer 1995;may; 16; 61(4):450-4.
17. Chang F, Syrjanen S, Nuutinen J, Karja J, Syrjanen K. Detection of human papillomavirus (HPV) DNA in oral squamous cell carcinomas by in situ hybridization and polymerase chain reaction. Arch Dermatol Res 1990;282(8):493-7.
18. Kansky AA, Poljak M, Seme K, Kocjan BJ, Gale N, Luzar B, Golouh R. Human papillomavirus DNA in oral squamous cell carcinomas and normal oral mucosa. Acta Virol 2003;47(1):11-6.
19. Koppikar P, deVilliers EM, Mulherkar R. Identification of human papillomaviruses in tumors of the oral cavity in an Indian community. Int J Cancer 2005;mar;113(6):946-50.
20. Sand L, Jalouli J, Larsson PA, Hirsch JM. Human papilloma viruses in oral lesions. Anticancer Res 2000;mar-apr;20(2B):1183-8.
21. Ibieta BR, Lizano M, Fras-Mendivil M, Barrera JL, Carrillo A, Ma Ruz-Godoy L, Mohar A. Human papilloma virus in oral squamous cell carcinoma in a Mexican population. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005;mar;99(3):311-5.Â
22. Summersgill KF, Smith EM, Kirchner HL, Haugen TH, Turek LP. p53 polymorphism, human papillomavirus infection in the oral cavity and oral cancer. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000;90(3):334-9
Peutz-Jeghers Syndrome: the importance of the relationship between dentists and physicians in achieving a diagnosis
* Carlos Eduardo Xavier dos Santos Ribeiro da Silva
** Artur Cerri
*** Francisco Octávio Teixeira Pacca
**** José Augusto Ferrari Cestari
. DDS, PhD Associate Prof of Oral Medicine- Santo Amaro University – Unisa, Brazil
** DDS, PhD, Chairman of Oral Medicine- Santo Amaro University – Unisa, Brazil
… DDS, PhD Associate Prof of Oral Medicine- Santo Amaro University – Unisa, Brazil
…. DDS, Specialist in Oral Medicine- Santo Amaro University – Unisa, Brazil
Mail address:
Rua Pelotas, 358 – Vila Mariana – SP- Brasil – 04012-010
dreduardosilva@terra.com.br
55 (11) 5571-1736
ABSTRACT
The Peutz-Jeghers (PJS) is an autossomal dominant condition. It´s predominant clinical features are melanosis in the oral mucosa and intestinal polyposis, with a tendency for malignant transformation. The dentists could be the first professional to detect the oral lesions, and aid in early diagnosis of the condition. Earlier is the diagnosis better is the prognosis since the intestinal polyposis could lead to malignant transformation. This publication is a case report from a patient that presented to the dentist for routine evaluation of the mouth, although later, she was diagnosed as a case of PJS.
INTRODUCTION
The Peutz-Jeghers (PJS) is an autossomal dominant condition, which prevalence is 1 in 8300 to 29000 births in USA (Bishop, Loftis e Nowicki, 2004 ). There is no sex or race predilection. Although this is a genetic autossomal dominant disease, just half of the patients give a positive family history during anamnesis.
The evolution of PJS during life, exposes the patient to a predisposition to developing malignant neoplasias, mainly in the small bowel, ceccum, rectum, as well as pancreatic adenocarcinomas. Other more rare carcinomas could occur in the breast, uterus, testicles and ovarium. The risk for cancer of those patients is 18 times higher in comparison with the general population, and as high as the number of intestinal polyps the higher is the chance for malignant transformation (Lindor, 2004). The first case of PJS, was presented by Hutchinson in 1896, when he described a case of twins with diffuse labial pigmentation. Peutz presented in 1921 a case of intestinal familial polyposis associated with hyperpigmentation of skin and mucosa in general. In 1949, Jeghers et al. complemented the association of pigmentation and intestinal polyposis and confirmed the familiar origin of the disease (Schreibman et al., 2005). Since then, these features together were denominated Peutz-Jeghers Syndrome (PJS). The Involved chromossome is 19p13.3 with apparent mutation in the locus (STK11) LKB1 with the enzyme serin/treonin kinase functionally inhibiting the tumoral supressor genes ( Doxey, Kuwada e Burt, 2005 ).
The melanotic pigmentation could be present at birth or appearing later in childhood, with characteristic distribution in the perioral mucosa (Pereira et al., 2005). It is important to emphasize that they are spots-like and not plaques, with alteration in color but not in the surface of the lesions. In the mouth, the main area of occurrence is the labial mucosa as well as the buccal mucosa, but they can also be found on the tongue, gingiva and hard palate, and are variable in number as well as in shape (Ciçek & Ertas, 2003 ). In the skin they occur in general on the dorsum of the hands and feet, and also the fingers. The lesions are very dark or dark blue, with a diameter ranging from 1 to 12 mm. When the melanotic spots are localized on the face, the diameter of the spots rarely are larger than 2 mm (Afolabi, 2003 ).
The skin lesions could disappear during puberty but the lesions in the mouth persists forever. The histological evaluation show higher amounts of melanin in the basal layer of the epithelium close to the basal lamina. The hamartomatous polyps are the main characteristic of the syndrome and they could vary in their shape, size, number and anatomical distribution, being found in different areas of gastrointestinal tract. In older patients, during colonoscopy multiple polyps are mainly found in the final bowel region. The polypus could be sessiles or pedunculated, with a diameter varying between 1 to 3 cm, and they could be considered capable to transformation in real cancer depending on the histological aspects seen in microscopy.
Approximatelly 35% of the patients with PJS were diagnosed in childhood or during puberty (Bronner, 2003 ). In general they complain of abdominal pain, compression of abdominal area, mainly in the region of intestinal colum, blood in the feces and frequent muscular spasm after ingestion of meals. There is alternating diarrhea and intestinal constipation. The symptoms of intestinal obstruction and/or hemorrage start to appear at 20 and 30 years of age. (Bronner, 2003 ).
When there is a suspaician of PJS, the gastrointestinal tract of the patient needs to be evaluated and examined by gastric endoscopy and colonoscopy, as well as the intestinal transit of fecal material by contrast radiographies. Other investigations are reactive proteín C, ferritin and hemogram, to detect inflammation and lost of blood in the feces (Schreibman et al., 2005 ). The histological examination of the oral pigmentation include large amounts of melanin in the basal layer of the epithelium. Considering the features of PJS, the differential diagnosis are: Crohn, Albright and Addison diseases .The gastroenterologist is the indicated professional to treat the disease more suitably.
CASE REPORT
A 24 years old single caucasian female, patient from São Paulo, attended in the Department of Oral Medicine of the School of Dentistry at Santo Amaro-Unisa, Brazil) for routine dental treatment. The clinical intra-oral exam revelead dark pigmented spots, painless, and varying in size and number, in the right and left sides of buccal mucosa and in the lips (Figs. 1,2). The general condition of oral hygiene was reasonable, although mild gingivitis was observed. The other aspects of the oral cavity were within normal limits.
Some inflammatory submandibular lymphnodes were observed bilaterally. During Medical history she did not mentioned any disease except some childhood diseases. Some lab investigations such as glycemia, hemogram, urine type I were within normal range.
The patient had never observed the pigmentation in the cheek and did not know the cause of them. The arterial blood pressure at the time of consultation was 120 x 80 mm Hg, the pulse was 85 bpm and the body temperature was 36.5° C. The color and the face was normal and without any pigmentation as well as in other regions of the body. The patient´s younger brother and deceased parents had no such symptoms.
The patient mentioned gastrointestinal problems such diffuse pain and intestinal constipation of many years duration, but she had never visited a gastroenterologist for consultation. All signs and symptoms were suggestive of Peutz-Jeghers Syndrome and so, the patient was advised to make an appointment with a gastroenterologist. We first asked for a dosage of ACTH to eliminate the possibility of Addison disease. An incisional biopsy was also accomplished in one of the pigmented spots. The microscopic result was melanotic pigmentation (fig 3). To investigate the possibility of Albright syndrome, radiographic from the femur, in different positions (front and lateral) were done, and the results showed normal bone aspects for the patient´s age. All the exams results were given to the patient in order to show to the gastroenterologist. The physicians requested for a colonoscopy and the result was positive for colon diverticular polyposis (fig.4), and the diagnosis of PJS have made. Currently the patient is under dental and medical treatment.
DISCUSSION
The dentist must guide the patient when any unusual signs and/or symptom are observed during an anamnesis and clinical examination.
Additionally the oral cavity is considered a part of the gastrointestinal tract of the individual. Any experienced clinician knows that a detailed examination of the oral cavity may show signs of many systemic diseases, for example anemia, leukemias, dermatological diseases, systemic diseases and several syndromes. Considering PJS particularly or any other disease, early diagnosis is very important for the patient and subsequent treatment. The dentist as a health professional, may have the opportunity to diagnose many systemic diseases, since many signs or symptoms of these disease may appear first in the mouth. In this specific case presented, the multiple pigmented lesions in childhood or puberty, scattered in the mouth and periorally, PJS must be considered in the diagnosis. Nowadays the dentists are well informed and have studied much more than in the past and know more about general pathology. Thus it is essential to establish an integration between all health professionals, mainly, dentists and physicians. Such interchangeable experiences and knowledge are of fundamental importance in diagnosis that would benefit the common patient. Thus always an early diagnosis could sometimes aid in management of the disease, thereby reducing morbidity and mortality of our patients.
CONCLUSIONS
The dentist must be capable of recognizing the characteristic signs and symptoms of Peutz-Jeghers Syndrome (PJS) in oral cavity and ascertain early diagnosis in connection with the patient physician.
Although it is a rare syndrome, if let alone, it could promote a gastrointestinal carcinoma, that could be lethal to the patient´s life.
In addition to an oral examination the dentist should request for further investigations if there is suspicion of any systemic disease with oral manifestations.
Unfortunately the biopsy is still not an investigation procedure routinely used by the dentist, but this conception must be changed.
– A patient suspected of PJS, should visit a gastroenterologist to confirm the diagnosis before any dental treatment has been started.
– Any alteration in color and/or pigmentation in the oral cavity, even without any other symptoms, should, in principle, be always investigated.
IMAGES
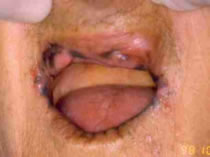
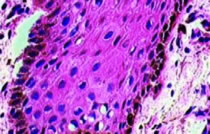
REFERENCES
Afolabi, O.O. Oral melanosis: a case report of Peutz-Jegher’s Syndrome in Suva, Fiji. Pac Health Dialog;10(1):55-6, 2003 Mar.
Bishop, P.; Loftis S; Nowicki M; What syndrome is this? Peutz-Jeghers syndrome.; Pediatr Dermatol;21(4):503-5, 2004 Jul-Aug.
Bronner, M.P.; Gastrointestinal polyposis syndromes.; Am J Med Genet A;122(4):335-41, 2003 Nov 1.
Ciçek, Y.; Ertas, U.; The normal and pathological pigmentation of oral mucous membrane: a review.; J Contemp Dent Pract;4(3):76-86, 2003 Aug 15
Doxey, B.W.; Kuwada, S.K.; Burt, R.W,; Inherited polyposis syndromes: molecular mechanisms, clinicopathology, and genetic testing.; Clin Gastroenterol Hepatol;3(7):633-41, 2005 Jul.
Lindor, N.M.; Recognition of genetic syndromes in families with suspected hereditary colon cancer syndromes.; Clin Gastroenterol Hepatol;2(5):366-75, 2004 May.
Pereira, C.M.; Coletta, R.D.; Jorge, J.; Lopes, M.A.; Peutz-Jeghers syndrome in a 14-year-old boy: case report and review of the literature. Int J Paediatr Dent;15(3):224-8, 2005 May.
Schreibman, I.R.; Baker, M.; Amos, C.; McGarrity, T.J.; The hamartomatous polyposis syndromes: a clinical and molecular review.; Am J Gastroenterol;100(2):476-90, 2005 Feb.
Preservation of inferior alveolar nerve during extensive segmental resection and it’s reconstruction with iliac bone for treatment of odontogenic myxoma

Carlos Eduardo X. S. Ribeiro da Silva, DDS, PhD
Francisco Octavio T. Pacca, DDS, PhD
Marcelo Nanni dos Santos, DDS
André Rodriguez, DDS
Artur Cerri, DDS, PhD
Santo Amaro University – UNISA- Sao Paulo, Brazil
(Background and Objectives) The odontogenic myxoma is a benign tumor of mesenchymal origin, locally invasive, recurrent with slow grow. While both jaws can be affected, this tumor is slightly more common in the mandible. If untreated, can achieve big dimensions with great possibility of morphofunctional damage. The therapeutic modalities ranging from curettage to in block resection. The aim of this study is to describe a clinical case of an extensive mandibular segmental resection for treatment of myxoma, its immediate reconstruction with autogenous bone with the preservation of the inferior alveolar nerve. (Methods) The patient was operated by sub-mandibular access, under general anesthesia, and removed a full segment of the mandible, approximately 8 cm, after careful dissection of the nerve. The reconstruction was made immediately through a placement of iliac autogenous bone graft and plate reconstruction. (Results) After 8 months of the procedure the patient meets with normal sensitivity in the region and the perfect integration of the bone block. Later held the installation of osseointegrated implants for rehabilitation of the region. (Conclusion) Even in large resections of the lower jaw, not cancer, it is possible to preserve the nerve with consequent maintenance of the sensitivity of the region, improving life quality for the patient.
Queilite actínica crônica estudo e correlações dos aspectos clínicos e histopatológicos
FRANCISCO OCTÁVIO TEIXEIRA PACCA*
GILBERTO MARCUCCI**
FÁBIO DAUMAS***
CARLOS EDUARDO XAVIER DOS SANTOS RIBEIRO DA SILVA****
RODRIGO ALARCON CERRI*****
ARTUR CERRI******
* Mestre e Doutor em Semiologia pela FOUSP, Professor Doutor Colaborador da Universidade de Santo Amaro (UNISA).
** Professor Titular da Disciplina de Semiologia da FOUSP.
*** Professor Livre Docente e Associado da Disciplina de Patologia Bucal da FOUSP.
**** Doutor em Estomatologia pela UNIFESP, Professor Doutor da Disciplina de Estomatologia da UNISA.
***** Especialista em Estomatologia pela UNISA, Estomatologista do Hospital Geral de São Paulo (HGeSP).
****** Mestre e Doutor em Semiologia pela FOUSP, Professor Doutor da Disciplina de Estomatologia da UNISA
Autor Correspondente:
FRANCISCO OCTÁVIO TEIXEIRA PACCA
Rua Pelotas, 358 – Vila Mariana – São Paulo – CEP 04012-010
Área de enfoque: ESTOMATOLOGIA
Categoria do artigo: Artigo Original
QUEILITE ACTÍNICA CRÔNICA
ESTUDO E CORRELAÇÕES DOS ASPECTOS CLÍNICOS E HISTOPATOLÓGICOS
RESUMO
A Queilite Actínica Crônica (QAC) é uma lesão labial considerada uma das principais lesões cancerizáveis da boca, em nosso estudo foram avaliados 29 pacientes portadores de QAC, observando e relacionando a epidemiologia da doença, os aspectos clínicos e histológicos bem como os respectivos graus de atipia celular. A QAC ocorreu em 100% nos indivíduos da raça branca, em 19 homens (65,51%) e 10 mulheres (34,49) e na idade média de 56,14 anos. Foram avaliados também os aspectos clínicos e histológicos da QAC sendo encontrados 14 casos de atipia epitelial discreta (48,27%), 10 casos de atipia epitelial moderada (34,49%) e 5 casos de atipia epitelial severa (17,24%). Através de análise estatística concluímos que clinicamente a presença de áreas leucoplasicas e o tempo de evolução da lesão superior a 5 anos estão diretamente relacionados aos casos de atipias epiteliais mais graves. O hábito de fumar e de beber parecem contribuir mas não obtiveram resultados estatisticamente significativos ao aparecimento da QAC.
Palavras-chave: queilite – boca
Keywords: Cheilitis – Mouth
CHRONIC ACTINIC CHEILITS
STUDY AND CORRELATIONS BETWEEN CLINICAL ASPECTS AND HISTOPATOLOGICAL FINDINGS
ABSTRACT
The Chronic Actinic Cheilitis (CAC) is a labial injury considered one of the main precancerous injuries of the mouth. Our study had been evaluated 29 carrying patients of CAC, observing and relating the epidemiology of the illness, clinical and histological aspects as well as the respective degrees of cellular atipia. The CAC occurred in 100% in the individuals of the white race, in 19 men (65.51%) and 10 women (34,49 %) and in the average age of 56,14 years. The clinical and histological aspects of the CAC found had been evaluated also. We found 14 cases of discrete epithelial atipia (48.27%), 10 cases of moderate epithelial atipia (34.49%) and 5 cases of severe epithelial atipia (17.24%). Through statistical analysis we concluded that the presence of leucoplasics areas and evolution time superior of 5 years are directly related to the cases of more dangerous epithelial atipias. The habit to smoke and drink seems to contribute but they had not gotten statistical significance to the appearance of the CAC.
1 INTRODUÇÃO
A etimologia da palavra queilite deriva do grego “keilos”, que significa lábios e são consideradas lesões actínicas, aquelas decorrentes da radiação actínica, que é um grupo da radiação ultra-violeta que oscila entre 2300 a 3200 A 1.
A Queilite Actínica Crônica é uma lesão de extrema importância por se tratar de uma lesão cancerizável2,3,4 .
Clinicamente, a QAC ocorre predominantemente em indivíduos acima de quarenta anos, leucodermas, do sexo masculino e que se expõe continuamente aos raios solares, como agricultores, marinheiros, pescadores, guardadores de carro, operários de construção e outros. A sua localização mais freqüente é o lábio inferior, pois este está anatomicamente mais exposto à ação maléfica dos raios solares5 . Clinicamente o lábio com QAC pode apresentar as seguintes alterações: descamações, ressecamento, fissuras, adelgaçamento do vermelhão, eritemas, edema, áreas esbranquiçadas, falta dos limites na linha de transição entre vermelhão e pele, crostas, perda da elasticidade, ulcerações e sangramento6 . A radiação solar é o agente etiológico da QAC e do câncer de lábio, muito embora se saiba que a probabilidade de malignização pode ser mais elevada, quando associada a outros fatores carcinogênicos, entre os quais o álcool e o fumo, nas suas mais variadas formas7,8.
2 REVISÃO DA LITERATURA
A queilite actínica crônica foi descrita e considerada como uma lesão cancerizável pela primeira vez, em 1886 por Dubrevil, durante o III Congresso Internacional de Dermatologia, realizado em Londres9 . Posteriormente, Ayres Jr. (1923), relacionou a etiologia da QAC com a exposição solar. Neste trabalho, foram examinados cinco pacientes provenientes de regiões quentes e secas da Califórnia e que desenvolviam atividades sob o sol constante, foram observadas as características clínicas das lesões bem como a prevenção de possível malignização10.
Como já comentado na introdução, Dufresne Jr. e Curlin (1997), descreveram as possíveis alterações clínicas para a QAC: edema, eritema, ressecamento, fissuras, descamações, falta de evidências dos limites entre vermelhão e pele, ulcerações, sangramentos, áreas leucoplásicas, crostas, adelgaçamento de vermelhão e perda da elasticidade labial6. Neste mesmo trabalho, Dufresne Jr. e Curlin (1997), estudaram os estágios clínicos da QAC descrevendo o eritema e o edema como as primeiras manifestações, enquanto nos estágios mais avançados foram observadas a presença de áreas leucoplásicas e as ulcerações6. A QAC pode apresentar as seguintes alterações histológicas: polaridade, nuclear alterada, relação núcleo citoplasma aumentada, hiperplasia das células basais, núcleos hipercromáticos, mitoses anormais, ortoqueratose, paraqueratose, maturação epitelial alterada, coesão celular reduzida, degeneração do colágeno (elastose), infiltrado inflamatório, ulceração, vasodilatação, acantose, e atrofia epitelial11 .
2.2 QAC e o câncer de lábio
O primeiro trabalho científico a relacionar o aspecto clínico com o quadro histológico da QAC e do câncer de lábio foi realizado por Nicolau e Ballus (1964). Os autores estudaram 542 pacientes com QAC e 76 pacientes com câncer de lábio, chegando a conclusão que a imensa maioria dos cânceres de lábio, é precedida de queilite actínica crônica12; daí a classificação proposta por Cataldo e Doku (1981), como sendo a QAC uma lesão com alto potencial de transformação maligna13. Alguns trabalhos na literatura tentam quantificar o percentual de malignização da QAC para o CEC de lábio, estes resultados variam de 12% a 20%9,14,15,16 .De qualquer forma o percentual é preocupante e coloca o diagnóstico precoce como fundamental. Huber e Terezhalmy (2006) descrevem que o potencial de malignação pode inclusive ultrapassar os 20% e enfatiza a importância de biopsiar todos os casos de QAC16. Outra característica do CEC de lábio é que seu aparecimento acomete principalmente indivíduos leucodermas acima da quinta década de vida submetidos a fatores desencadeantes8.
A radiação solar é considerada o principal fator desencadeante do CEC de lábio inferior. Os danos induzidos pela radiação ultravioleta B (UVB) se devem a sua intensa absorção pelos ácidos nucleicos. A maior parte dos danos é causada por alterações que impedem a transcrição da informação genética para o ácido ribonucleico mensageiro (RNA m) e bloqueiam o mecanismo de duplicação do ácido desoxirribonucleico (DNA). De forma bastante simplificada, as reações fotoquímicas que alteram o DNA podem ocorrer na estrutura primária dos nucleotídeos ou no rompimento de hélices e pontes de hidrogênio. Estas alterações comumente provocam a geração de produtos que podem bloquear, ainda que parcialmente, as enzimas de separação dos ácidos nucleicos 17.
Outros agentes desencadeantes do câncer de lábio inferior são citados na literatura há bastante tempo, dentre eles o tabaco e o álcool8. No tabaco e na fumaça que deles se desprende, podem ser identificadas cerca de 4.700 substâncias tóxicas. Dentre estas, 60 apresentam ação carcinogênica conhecida, destacando-se os hidrocarbonetos policíclicos e as nitrosaminas específicas do tabaco. Outras substâncias carcinogênicas também são detectadas no tabaco e na sua fumaça, dentre elas, elementos radioativos como o carbono 14 e o polônio 210, como também resíduos de agrotóxicos utilizados na lavoura do tabaco como o diclorodifeniltricloretano (DDT) e outros18 .
Além da ação maléfica das substâncias cancerígenas, a exposição contínua ao calor desprendido pela combustão do fumo potencializa as agressões sobre a mucosa e semimucosa, pois sabemos que a temperatura na ponta do cigarro varia de 835 a 884ºC19. Sabe-se que o álcool se apresenta como agente promotor do câncer, interferindo principalmente na velocidade e na quantidade de reparação dos defeitos do DNA, induzidos pelos carcinógenos verdadeiros como o tabaco e a radiação.
O álcool pode agir no desenvolvimento do câncer das seguintes formas:
– Aumento de permeabilidade das células da mucosa e semimucosa aos agentes carcinogênicos, devido ao efeito solubilizante do álcool.
– Agressão celular produzida pelos metabólitos do etanol, os chamados aldeídos.
– Deficiências nutricionais secundárias ao consumo crônico do próprio álcool.
– Diminuição dos mecanismos locais de defesa.
Segundo o manual de “Detecção de lesões suspeitas de câncer de boca”, Instituto Nacional do Câncer (INCA), quando o alcoolismo e o tabagismo se associam, o risco relativo de câncer bucal é potencializado drasticamente, sendo 141,6 vezes maior do que em pacientes que não fumam e não bebem18. Outro importante fator a ser considerado ao aparecimento do câncer, são as deficiências nutricionais e dietas inadequadas, ricas em fontes formadoras de radicais livres, pois estes também são responsáveis por alterações no DNA. Sabe-se hoje que uma alimentação rica em proteínas A, E, C e B2 e alguns minerais como o cálcio, zinco e selênio, são considerados antagonistas de radicais livres, chamados de antioxidantes20. Para Lindqvist, Teppo e Pukkala (1981), a dieta nutricional pobre em betacaroteno (precursor da vitamina A) associada à exposição solar e ao fumo, também representa um importante fator a ser considerado21. Garewal (1993) verificou um baixo risco de desenvolvimento de câncer de boca entre indivíduos que consumiam altos índices de frutas cítricas e vegetais ricos em beta-caroteno22. Por estes motivos, é incentivado cada vez mais o hábito do consumo de frutas e vegetais23.
3 PROPOSIÇÃO
A proposta de nosso estudo foi avaliar os aspectos clínicos, histológicos e epidemiológicos da QAC .
4 MATERIAL E MÉTODO
Foram selecionados para o presente estudo 29 pacientes portadores de QAC e um grupo controle de 29 pacientes sem nenhuma evidência de lesão labial inferior que foi selecionado fazendo-se o pareamento de raça, gênero e idade com o grupo doente
4.1 Avaliação clínica
Todos os pacientes foram submetidos a exame clínico completo e ordenado, composto por anamnese, exame físico extra e intra-bucal. O exame clínico e o atendimento dos pacientes foram realizados na clínica de Semiologia da FOUSP.
4.2 Critérios adotados para a interpretação da ficha clínica
Foram considerados fumantes os indivíduos que fumam ou que fumaram regularmente durante alguma época da vida (pelo menos por cinco anos), mesmo aqueles que abandonaram o vício de fumar e foram considerados etilistas os indivíduos que bebem ou que beberam (diariamente) em qualquer época da vida (pelo menos por cinco anos)
4.3 Coleta do material
Os pacientes do grupo doente foram submetidos a biópsia incisional utilizando-se para esse fim um punch número 3 (diâmetro aproximado de 3 mm). O material colhido foi acondicionado em formol a 10% para realização do exame histopatológico com coloração em hematoxilina e eosina (HE)
4.4 Critérios adotados para a interpretação das lâminas histológicas
Os aspectos histológicos das QAC foram interpretados seguindo a classificação de displasia epitelial de Van Der Waal (1986), que analisa e enumera os seguintes achados histológicos: 1- relação núcleo citoplasma aumentada, 2 – polaridade nuclear alterada, 3 – hiperplasia das células basais, 4 – núcleos hipercromáticos, 5 – mitoses anormais, 6 – maturação epitelial alterada, 7 – coesão celular reduzida, 8 – queratinização alterada, 9 – nucléolos aumentados24. A análise da graduação da atipia foi baseada no trabalho de Bánóczy e Csiba (1976) e oficializada pela World Health Organization (WHO, 1978) que classificaram como leve, quando dois achados histológicos estavam presentes; moderada, quando três ou quatro desses achados histológicos eram notados e, severa, quando cinco ou mais achados histológicos estavam presentes25,26. Outros aspectos histológicos estão presentes nos casos de QAC, como: degeneração do colágeno (elastose), infiltrado inflamatório, vasodilatação, acantose e atrofia, mas estas características não são levadas em consideração por Van Der Waal (1986) em sua classificação24.
4.5 Análise estatística
Para avaliar se o hábito de fumar e o consumo de álcool poderiam ser fatores de risco para a doença, foram utilizadas técnicas de regressão logística, para isso foram estimadas odds ratios (OR) e seus respectivos intervalos de confiança (IC) (com coeficiente de confiança de 95%). Inicialmente foi realizada uma análise univariada, ou seja, foi avaliada a contribuição individual de cada fator para explicar a presença da doença, sem levar em conta os demais fatores ou outras variáveis de confusão. Uma vez que nenhum dos fatores estudados foi significante para explicar a presença de doença, nenhum tipo de análise multivariada foi realizado.
Considerando apenas os pacientes com a doença, desejou-se avaliar se a idade, o tempo de doença e os fatores clínicos estavam associados com o grau de atipia da doença. Uma vez que poucos pacientes apresentaram um grau de atipia severo, decidiu-se agrupar as categorias “moderado” e “severo”, a fim de aumentar o número de pacientes em cada categoria, além de possibilitar o uso de modelos de regressão logística, que são relativamente simples de ajustar e oferecem resultados de fácil interpretação. Assim, a variável resposta nos modelos foi o grau de atipia (discreto ou moderado/severo). As variáveis explicativas foram a idade, o tempo de doença e os fatores clínicos. A idade e o tempo de doença foram categorizadas com o objetivo de facilitar a interpretação dos resultados. Optou-se por utilizar 3 faixas etárias, estabelecidas de modo a acomodar mais ou menos o mesmo número de pacientes em cada faixa. Para a variável tempo de doença, procurou-se gerar categorias de tal forma que houvesse pelo menos um paciente com atipia moderada ou severa em cada categoria. Inicialmente, foi realizada a análise univariada, onde foi calculado o número e a porcentagem de pacientes que apresentaram atipia moderada ou severa nas categorias de cada uma das variáveis explicativas. Para cada variável explicativa foi ajustado um modelo de regressão logística univariada, a partir do qual obtivemos a estimativa da odds ratio e do seu respectivo intervalo de confiança (com coeficiente de confiança de 95%).
A seguir, foi realizada a análise de regressão logística múltipla. Dado o grande número de variáveis explicativas, decidimos utilizar o método stepwise forward 27. As variáveis explicativas foram introduzidas uma a uma no modelo, da mais importante para a menos importante. A ordem de “importância” das variáveis foi definida segundo o logaritmo da verossimilhança do modelo univariado (quanto menor o valor de “–2 x logaritmo da verossimilhança”, mais importante a variável em questão). A cada passo desta abordagem, uma nova variável era introduzida ou retirada do modelo. Utilizamos como critérios para decidir se uma determinada variável deveria permanecer ou não no modelo o fato de o seu coeficiente ser significante ou marginalmente significante (nível descritivo do teste de Wald = 0.10). Após estas análises, foram testadas todas as interações possíveis entre essas variáveis que permaneceram no modelo, duas a duas, permanecendo apenas as que foram significantes. Após esse procedimento, foi definido o modelo final e estimados os seus parâmetros.
5 RESULTADOS
5.1 Aspectos epidemiológicos
Na avaliação da ficha clínica dos pacientes envolvidos na pesquisa, observamos que dos 29 pacientes com queilite actínica crônica, 19 são homens e 10 são mulheres. Com o objetivo de parear o nosso grupo controle, incluímos para o estudo também 29 pacientes, sendo também 19 homens e 10 mulheres, com média etária semelhante ao do grupo com QAC.
No quadro 1, verificamos os resultados epidemiológicos da nossa pesquisa.
|
QAC |
Lábio Normal |
|
|
Raça branca |
100% |
100% |
|
homens |
19 |
19 |
|
mulheres |
10 |
10 |
|
Idade média |
56,14 anos |
55,21 anos |
|
Fumantes |
48,28% |
34,48% |
|
Não fumantes |
51,72% |
65,52% |
|
Etilistas |
10,34% |
3,44% |
|
Não etilistas |
89,66% |
96,56% |
|
Fumantes e etilistas |
10,34% |
3,44% |
Quadro 1 – Aspectos epidemiológicos dos pacientes portadores de QAC e com lábio normal
O quadro 2 contém algumas medidas descritivas para as variáveis de pareamento.
|
QAC |
Lábio Normal |
|
|
Raça branca |
n=29 (100%) |
n=29 (100%) |
|
Homens |
n=19 (66%) |
n=19 (65%) |
|
Mulheres |
n=10 (34%) |
n=10 (34%) |
|
Idade |
média = 56,14 anos |
média = 55,21 anos |
|
mínimo = 43 anos máximo = 72 anos |
mínimo = 52 anos |
Quadro 2 – Medidas descritivas para as variáveis de pareamento
O quadro 3 analisa a presença da QAC com relação ao fumo e ao álcool
|
N |
QAC |
% de QAC |
OR |
IC (OR, 95%) |
p |
|
|
Fumo |
||||||
|
não |
34 |
15 |
44 |
|||
|
sim |
24 |
14 |
58 |
1,77 |
0,54 a 5,85 |
0,29 |
|
Álcool |
||||||
|
não |
54 |
26 |
48 |
|||
|
sim |
4 |
3 |
75 |
3,23 |
0,24 a 175,53 |
0,30 |
Quadro 3 – Análise univariada (variável resposta – QAC: presente ou ausente)
Os resultados no quadro 3 sugerem que indivíduos que fumam têm mais chance de ter QAC do que indivíduo que não fumam, entretanto, este resultado não é estatisticamente significante. A chance de ter a doença entre os pacientes que fumam é 1,77 vezes a chance daqueles que não fumam (quase o dobro), entretanto o intervalo de confiança para a odds ratio contém o valor 1 (IC = 0,54 a 5,85; p=0,29). Analogamente, a chance dos indivíduos que consomem álcool terem a doença é 3.23 vezes a chance dos que não consomem, mas este resultado não é estatisticamente significante (p=0.30)
Figura 1 – Aspectos epidemiológicos dos pacientes portadores de QAC e com lábio normal em relação ao tabagismo
Figura 2 – Aspectos epidemiológicos dos pacientes portadores de QAC e com lábio normal em relação ao etilismo
5.2 Aspectos clínicos
Todos os pacientes com QAC foram avaliados clinicamente e analisados criteriosamente os seguintes sinais e sintomas clínicos: ressecamento, descamação, fissuras, adelgaçamento do vermelhão, eritemas, edema, sangramento, áreas leucoplásicas, alteração na linha de transição entre vermelhão e pele, crostas, perda da elasticidade labial (elastose), sintomatologia (dor, ardências etc) e ulcerações.
Os seguintes resultados foram observados (Figura 3):
– Ressecamento – 29 casos (100% dos casos)
– Alteração na linha de transição – 27 casos (93,10% dos casos)
– Descamação – 23 casos (79,31% dos casos)
– Eritemas – 23 casos (79,31% dos casos)
– Adelgaçamento do vermelhão – 22 casos (75,86% dos casos)
– Áreas leucoplásicas – 18 casos (62,06% dos casos)
– Fissuras – 16 casos (55,17% dos casos)
– Elastose labial – 16 casos (55,17% dos casos)
– Crostas – 9 casos (31,03% dos casos)
– Ulcerações – 7 casos (24,13% dos casos)
– Edema – 3 casos (10,34% dos casos)
– Sintomatologia – 2 casos (6,89% dos casos)
– Sangramento – 1 caso (3,44% dos casos)
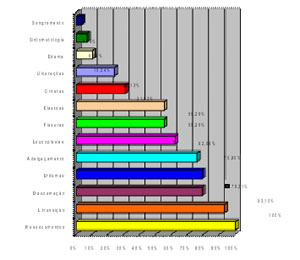
Figura 3 – Aspectos clínicos encontrados nos pacientes com QAC
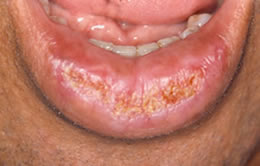
Figura 4 – Exemplo de QAC de nosso estudo (caso 22) demonstrando ressecamento labial,alteração na linha de transição entre vermelhão e pele, edema e elastose labial, crostas, áreas eritematosas, ulceração, adelgaçamento do vermelhão e algumas áreas leucoplásicas
5.3 Aspectos histológicos
Todas as lâminas histológicas foram analisadas e confirmados os diagnósticos de QAC, sendo estes resultados classificados como QAC discreta, moderada e severa, na dependência dos níveis de atipia epitelial encontrados.
Dos 29 casos biopsiados, encontramos os seguintes resultados (Figura 5):
– 14 casos de QAC com atipia epitelial discreta (48,27% dos casos)
– 10 casos de QAC com atipia epitelial moderada (34,49% dos casos)
– 5 casos de QAC com atipia epitelial severa (17,24% dos casos)
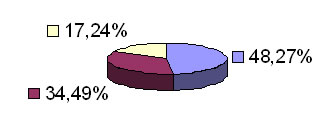
Figura 5 – Graus de atipia celular observados nos 29 casos de QAC
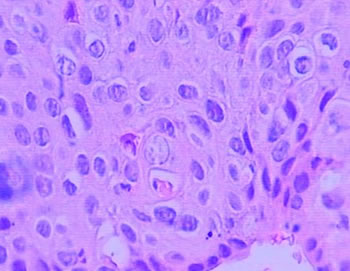
Figura 6 – Exemplo de QAC (aspecto histológico) de nosso estudo com atipia severa (caso 22), verificamos, relação núcleo citoplasma aumentada, núcleos hipercromáticos, maturação epitelial alterada (pleomorfismo da camada espinhosa), polaridade celular alterada, cromatina com distribuição irregular e nucléolos aumentados (aumento de 400 x)
5.4 Análise estatística dos resultados (clínicos, histológicos e epidemiológicos)
Confeccionamos uma tabela para estudo relacionando idade, duração da lesão, sexo, hábito de fumar, características clínicas com os graus de atipia (apresentados na avaliação histológica dos nossos casos) (Tabela 1).
|
Atipia moderada ou severa |
|||||||||||||
|
N |
n |
% |
OR |
IC(OR, 95%) |
-2logλ |
Ordem |
|||||||
|
Idade (anos) |
|||||||||||||
|
43 a 52 |
10 |
5 |
50.0 |
1.0 |
|||||||||
|
53 a 59 |
9 |
7 |
77.8 |
3.5 |
0.5 a 25.9 |
||||||||
|
60 a 72 |
10 |
3 |
30.0 |
0.4 |
0.1 a 2.7 |
36.6 |
7 |
||||||
|
Duração (anos) |
|||||||||||||
|
5 ou menos |
14 |
3 |
21.4 |
1.0 |
|||||||||
|
6 a 10 |
10 |
7 |
70.0 |
8.6 |
* |
1.3 a 54.9 |
|||||||
|
mais de 10 |
5 |
5 |
100.0 |
5.9E+09 |
0.0 a + ∞. |
26.8 |
— |
||||||
|
Duração (anos) |
|||||||||||||
|
5 ou menos |
14 |
3 |
21.4 |
||||||||||
|
mais de 5 |
15 |
12 |
80.0 |
14.667 |
** |
2.4 a 88.5 |
29.6 |
2 |
|||||
|
Sexo |
|||||||||||||
|
homens |
19 |
12 |
63.2 |
1.0 |
|||||||||
|
mulheres |
10 |
3 |
30.0 |
0.3 |
0.0 a 1.3 |
37.2 |
8 |
||||||
|
Hábito de fumar |
|||||||||||||
|
não |
15 |
5 |
33.3 |
1.0 |
|||||||||
|
sim |
14 |
10 |
71.4 |
5.0 |
* |
1.0 a 24.3 |
35.8 |
6 |
|||||
|
Álcool |
|||||||||||||
|
não |
26 |
12 |
46.2 |
1.0 |
|||||||||
|
sim |
3 |
3 |
100.0 |
1.9E+09 |
0.0 + ∞. |
35.9 |
— |
||||||
|
Alt.linha trans. |
|||||||||||||
|
não |
2 |
1 |
50.0 |
1.0 |
|||||||||
|
sim |
27 |
14 |
51.9 |
1.1 |
0.1 a 19.0 |
40.2 |
13 |
||||||
|
Descamação |
|||||||||||||
|
não |
6 |
2 |
33.3 |
1.0 |
|||||||||
|
sim |
23 |
13 |
56.5 |
2.6 |
0.4 a 17.2 |
39.1 |
9 |
||||||
|
Eritema |
|||||||||||||
|
não |
6 |
2 |
33.3 |
1.0 |
|||||||||
|
sim |
23 |
13 |
56.5 |
2.6 |
0.4 a 17.2 |
39.1 |
10 |
||||||
|
Adelgaçamento |
|||||||||||||
|
não |
7 |
1 |
14.3 |
1.0 |
|||||||||
|
sim |
22 |
14 |
63.6 |
10.5 |
* |
1.1 a 103.5 |
34.6 |
5 |
|||||
|
Atipia moderada ou severa |
|||||||||||||
|
N |
n |
% |
OR |
IC(OR, 95%) |
-2log |
Ordem |
|||||||
|
Leucoplasia |
|||||||||||||
|
não |
11 |
1 |
9.1 |
1.0 |
|||||||||
|
sim |
18 |
14 |
77.8 |
35.0 |
** |
3.4 a 362.2 |
25.8 |
1 |
|||||
|
Fissuras |
|||||||||||||
|
não |
13 |
10 |
76.9 |
1.0 |
|||||||||
|
sim |
16 |
5 |
31.3 |
0.1 |
* |
0.0 a 0.7 |
33.9 |
4 |
|||||
|
Elastose |
|||||||||||||
|
não |
13 |
3 |
23.1 |
1.0 |
|||||||||
|
sim |
16 |
12 |
75.0 |
10.0 |
** |
1.8 a 55.6 |
32.0 |
3 |
|||||
|
Crosta |
|||||||||||||
|
não |
22 |
8 |
36.4 |
1.0 |
|||||||||
|
sim |
7 |
7 |
100.0 |
0.7 |
0.1 a 3.2 |
39.9 |
11 |
||||||
|
Ulceração |
|||||||||||||
|
não |
22 |
8 |
36.4 |
1.0 |
|||||||||
|
sim |
7 |
7 |
100.0 |
2.8E+09 |
0.0 a + ∞ |
28.8 |
— |
||||||
|
Edema |
|||||||||||||
|
não |
26 |
12 |
46.2 |
1.0 |
|||||||||
|
sim |
3 |
3 |
100.0 |
1.9E+09 |
0.0 a + ∞. |
35.9 |
— |
||||||
|
Sintomatologia |
|||||||||||||
|
não |
27 |
14 |
51.9 |
1.0 |
|||||||||
|
sim |
2 |
1 |
50.0 |
0.9 |
0.1 a 16.4 |
40.2 |
12 |
||||||
|
Sangramento |
|||||||||||||
|
não |
28 |
15 |
53.6 |
1.0 |
|||||||||
|
sim |
1 |
0 |
0.0 |
0.0 |
0.0 + ∞ |
38.7 |
— |
||||||
* p<0.05 **p<0.01
Tabela 1 – Análise univariada (variável resposta – Grau de Atipia: discreto ou moderado/severo)
A tabela 1 apresenta os resultados da análise univariada. A variável resposta nos modelos foi o grau de atipia (discreto ou moderado/severo). As variáveis explicativas foram a faixa etária, o tempo de doença e os fatores clínicos. O grau de atipia não parece estar associado com a faixa etária, o sexo, a presença de alteração na linha de transição entre pele e vermelhão, descamação, eritema, crosta e sintomatologia. As variáveis álcool, ulceração e edema parecem estar associadas ao grau de atipia, já que os todos pacientes com a presença de algumas dessas características apresentam atipia modedada/severa. Entretanto, o número de pacientes nessas circunstâncias é muito pequeno (3, 7 e 3), o que não permite a estimação de intervalos de confiança robustos para a odds ratio. Em geral, os intervalos variam de 0 até infinito, impossibilitando maiores conclusões. É possível que um estudo com mais pacientes possa confirmar a sugestão de que álcool, ulceração e edema são características muito relacionadas as atipias histológicas mais graves. Na análise das variáveis duração da doença, hábito de fumar, adelgaçamento, leucoplasias, fissuras e elastose verificamos que estas mostram-se realmente associadas ao grau de displasias epiteliais. Em geral, pacientes com a presença dessas características (exceto fissuras) parecem apresentar maior chance de ter atipia moderada/grave do que pacientes sem essas características. Já para a variável fissuras ocorre o oposto, isto é, pacientes com fissuras parecem ter menos chance de ter atipia moderada/grave do que pacientes com essa característica. Para avaliar a contribuição de cada variável para o grau de atipia, controlando para a presença das demais variáveis, ajustamos modelos de regressão logística múltipla, utilizando um método stepwise forward. As variáveis foram inseridas uma a uma, da menos importante para a mais importante. A tabela 2 apresenta as estimativas da odds ratio para os 6 primeiros modelos de regressão logística múltipla.
|
Variável |
Modelo |
|||||
|
explicativa |
1 |
2 |
3 |
4 |
5 |
6 |
|
Leucoplasia |
||||||
|
não |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
|
sim |
35.0** |
19.6** |
12.6* |
17.1* |
16.6** |
12.4* |
|
Duração (anos) |
||||||
|
5 ou menos |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
|
|
mais de 5 |
7.1* |
7.2* |
5.6 |
5.5 |
11.2* |
|
|
Elastose |
||||||
|
não |
1.0 |
|||||
|
sim |
3.4 |
|||||
|
Fissuras |
||||||
|
não |
1.0 |
|||||
|
sim |
0.4 |
|||||
|
Adelgaçamento |
||||||
|
não |
1.0 |
|||||
|
sim |
2.6 |
|||||
|
Hábito de fumar |
||||||
|
não |
1.0 |
|||||
|
sim |
5.9 |
|||||
* p<0.05 **p<0.01
Tabela 2 – Odds ratio estimadas para os 6 primeiros modelos de regressão logística múltipla, através do método stepwise forward
No passo 1 inserimos a variável leucoplasia, que foi estatisticamente significativa (p<0.05) e permaneceu no modelo. No passo 2 acrescentamos a variável duração da doença. Esta variável foi marginalmente significativa (p<0.10) e por isto também permaneceu no modelo. Note que a estimativa da OR da variável leucoplasia diminuiu do modelo 1 para o modelo 2, sugerindo que uma parte do efeito da variável leucoplasia observado no modelo 1 era devido, de fato, ao tempo de doença. No passo 3 acrescentamos a variável elastose, entretanto esta variável não foi significativa e não permaneceu no modelo. Nos passos seguintes inserimos as demais variáveis, mas nenhuma delas permaneceu no modelo. Assim, dentre as variáveis estudadas, “leucoplasia” e “duração da doença” são suficientes para explicar o grau de atipia. A tabela 3 apresenta as estimativas do modelo final (modelo 2), que contém apenas as variáveis leucoplasia e duração da doença. Segundo esse modelo, pacientes com leucoplasia têm mais chance de ter atipia moderada/severa do que pacientes sem leucoplasia. Analogamente, pacientes com mais de 5 anos de doença têm mais chance de ter atipia moderada/severa do que pacientes com 5 anos de doença ou menos.
|
Variável explicativa |
OR |
IC(OR, 95%) |
p-valor |
|
Leuco |
|||
|
não |
|||
|
sim |
19.6 |
1.7 a 233.0 |
.02 |
|
Duração (anos) |
|||
|
5 ou menos |
|||
|
mais de 5 |
7.1 |
0.9 a 59.1 |
.07 |
Tabela 3 – Estimativas do modelo final de regressão logística
Finalmente, é extremamente importante ressaltar que conclusões sobre estas análises devem ser interpretadas com cautela. Devemos considerar que os resultados da análise de regressão logística múltipla poderiam ter sido diferentes se os modelos tivessem contemplado as variáveis álcool, ulceração e edema (que foram excluídas devido ao pequeno número de pacientes). Além disso, nota-se que não fizemos grandes afirmações sobre a força das associações ou a magnitude do efeito de cada variável sobre o grau de atipia (representado pelo valor da odds ratio), mas apenas sobre a presença ou ausência de associação, determinado pelo fato de a odds ratio ser significantemente maior do que 1, do ponto de vista estatístico. Isto ocorreu porque o evento sob estudo (presença de tipia moderada/severa) é um evento freqüente entre pacientes com QAC. Lembramos que a odds ratio pode ser utilizada como estimativa da magnitude do risco de ocorrência do evento apenas quando trata-se de um evento raro. Entretanto, os modelos fornecem estimativas confiáveis sobre a presença ou ausência de associação.
6 DISCUSSÃO
A QAC é considerada uma lesão cancerizável e tem como agente etiológico bem definido a radiação solar1. Dardanoni (1984), consideraram as características étnicas de pele clara um dos mais poderosos fatores de risco para a QAC e o câncer de lábio28. Em nosso trabalho, verificamos que 100% dos pacientes com QAC eram da raça branca. Recentes trabalhos descrevem a prevalência da QAC como acometendo principalmente pacientes acima da quinta década de vida8, estes dados foram confirmados em nossa pesquisa, pois observamos uma média de idade em nossos pacientes portadores de QAC de 56,14 anos. Inúmeros trabalhos científicos no decorrer dos anos, descrevem as formas clínicas e histológicas da QAC, mas nenhum deles apresentou esses dados de forma percentual13,15,29
Aguiar (1995) foi a primeira a analisar alguns aspectos clínicos da QAC de forma mais detalhada30. Em seu estudo foram avaliados 69 pacientes com QAC chegando aos seguintes resultados: eritema em 71,01% (em nosso estudo encontramos 79,31%), descamação em 69,56% (em nosso estudo 79,31%), ulceração em 15,94% (em nosso estudo 24,13%), infiltração ou elastose em 40,57% (em nosso estudo 55,17%), crosta em 13,04% (em nosso estudo 31,03%), atrofia ou adelgaçamento do vermelhão em 71,01% (em nosso estudo 75,86%), áreas leucoplásicas em 37,68% (em nosso estudo 62,06%), alteração na linha de transição entre pele e vermelhão em 88,40% (em nosso estudo 93,10%). Percebemos que de maneira geral, em nossos pacientes as alterações clínicas encontradas foram mais freqüentes. Em recente trabalho, Cavalcanti (2008) analisou também 29 pacientes com QAC verificando os graus de atipias celulares encontradas, todos os casos apresentaram atipia epitelial nas seguintes proporções: atipia moderada em 10,35%, atipia moderada em 27,59% e atipia severa em 62,06% dos casos11. Interessante compararmos estes resultados, pois eles são absolutamente antagônicos aos de nosso estudo, pois em nossos pacientes encontramos 48,27% de atipias discretas, 34,49% de atipias moderadas e 17,24% de atipias severas. Esta variação pode ser justificada quando avaliamos o perfil dos pacientes do trabalho de Cavalcanti (2008), pois na sua grande maioria eram pacientes lavradores que trabalham por períodos prolongados e por vários anos sob a ação maléfica dos raios solares11. Já em nosso estudo, o padrão de atividades profissionais de nossos pacientes é mais variado e até mesmo pelo fato dos participantes da pesquisa residirem em áreas urbanas. Em nosso estudo, fizemos uma avaliação estatística detalhada, correlacionando os aspectos clínicos da QAC e o hábito de fumar e beber com a incidência de atipias moderadas e severas. Na análise dos resultados, o grau de atipia não se mostrou associado a faixa etária, ao sexo, a presença de alteração na linha de transição, descamação, eritema, crosta e sintomatologia. Como já foi comentado no capítulo de resultados, as variáveis álcool. ulceração e edema parecem estar associadas ao grau de atipia, pois todos os pacientes com a presença dessas características apresentam atipia moderada/severa. Entretanto, o número de pacientes com estas características é muito pequeno (3, 7 e 3 respectivamente), o que não permitiu conclusões estatisticamente significativas para que o hábito de consumir bebida alcoólica, a presença de ulceração e edema estivessem associados ao grau de atipia. Também foi citado no capítulo anterior que as variáveis: duração da doença, hábito de fumar, adelgaçamento de vermelhão, leucoplasias, elastose e fissuras, mostraram-se associadas ao grau de displasias epiteliais. Em geral, pacientes com a presença dessas características (exceto fissuras) parecem apresentar maior chance de ter atipia moderada/severa do que pacientes sem essas características. Já para a variável fissuras ocorreu o oposto, isto é, pacientes com fissuras parecem ter menos chance de ter atipia moderada/severa do que pacientes com essa característica.
As variáveis duração da lesão e leucoplasia foram as únicas que estatisticamente podem ser consideradas como conclusivamente associadas ao grau de displasia epitelial. É importante ressaltar que em nos nossos casos que foram classificados como atipia epitelial severa no resultado das biópsias, os pacientes foram submetidos a vermelhectomia e nos casos de atipia moderada e discreta os pacientes foram orientados para controles periódicos em nosso ambulatório.
Sem dúvida, a QAC está relacionada ao câncer de lábio e ambos relacionados diretamente à exposição solar embora a literatura também descreva o fumo como um fator a ser considerado1,7,15. Esta correlação foi também percebida em nossos resultados, pois encontramos 48,28% de fumantes com QAC enquanto que pacientes com lábio normal, 34,48% tinham o hábito de fumar, apesar desta diferença, em nossa análise estatística estes valores não podem ser considerados conclusivos.
Lindqvist, Teppo e Pukkala (1981) concluíram em seu estudo na Finlândia que a baixa de resistência da semi-mucosa labial causada pelo trabalho ao ar livre e o consumo de bebida alcoólica levam a um aumento na susceptibilidade aos agentes carcinogênicos do tabaco21. Em nosso estudo foi verificada uma tendência maior ao aparecimento da QAC em pacientes etilistas muito embora como o número dos etilistas foi pequeno tanto no grupo doente (3 pacientes) como no grupo controle (1 paciente), este resultado não foi estatisticamente significante.
7 CONCLUSÕES
Os resultados obtidos por meio das metodologias por nós utilizadas, nos permitem concluir que:
– A QAC ocorreu em 100% nos indivíduos da raça branca, mais no gênero masculino (19 homens e 10 mulheres) e na idade média de 56,14 anos.
– Dos aspectos clínicos da QAC analisados, o ressecamento labial foi o único que se mostrou presente em 100% dos casos.
– Pacientes com QAC que apresentam clinicamente áreas leucoplásicas tem estatisticamente mais chance de apresentar atipias epiteliais moderadas e severas.
– O fumo isoladamente como também a sua associação com o álcool não foram estatisticamente significantes na contribuição para o aparecimento da QAC.
– Os aspectos histológicos da QAC mostram que das 29 lâminas analisadas, encontramos atipia discreta em 14 casos, moderada em 10 e severa em 5.
– Pacientes com QAC por mais de 5 anos têm estatisticamente mais chance de apresentar atipias epiteliais moderadas e severas.
REFERÊNCIAS
1. Pacca FOT, Cerri A, Silva CEXSR, Silva SS. Queilite actínica: relato de caso clínico e tratamento com ácido tricloroacético. Rev Bras Cir Cabeça Pesc 1999;23(3):103-6.
2. de Freitas Mda C; Ramalho LM; Xavier FC; Moreira AL; Reis SR. p53 and MDM2 protein expression in actinic cheilitis.J Appl Oral Sci;16(6):414-9, 2008 Nov-Dec.
3. Gomes AP; Johann JE; Lovato GG; Ferreira AM Comparative analysis of the mast cell density in normal oral mucosa, actinic cheilitis and lip squamous cell carcinoma. Braz Dent Journal;19(3):186-9, 2008.
4. Chou A; Dekker N; Jordan RC. Identification of novel fibroblast growth factor receptor 3 gene mutations in actinic cheilitis and squamous cell carcinoma of the lip. Oral Surg Oral Med Oral Pathol Oral Radiol Endod;107(4):535-41, 2009 Apr..
5. Dufresne RG; Cruz AP; Zeikus P; Perlis C; Jellinek NJ. Dermabrasion for actinic cheiliti. Dermatol Surg;34(6):848-50, 2008 Jun
6. Dufresne Jr. RG, Curlin MU. Actinic cheilits: a treatment review. Dermatol Surg 1997;23(1):15-21.
7. Douglas CW, Gammon MD. Reassessing the epidemiology of lip cancer. Oral Surg Oral Med Oral Pathol 1984;57(6):631-42.
8. Markopoulos A, Albanidou-Farmaki E, Kayavis I. Actinic cheilitis: clinical and pathologic characteristics in 65 cases. Oral Dis 2004;10(4):212-6.
9. Schwartz RA, Stoll HL. Epithelial precancerous lesions. In: Fitzpatrick TB, Eisen AZ, Wolff K, Freedberg IM, Austen KF. Dermatology in general medicine. 4.ed. New York: McGraw-Hill; 1993.
10. Ayres Jr. S. Chronic actinic cheilitis. J Am Med Assoc 1923;81(14):1183-5.
11. Cavalcante AS; Anbinder AL; Carvalho YRActinic cheilitis: clinical and histological features. J Oral Maxillofac Surg;66(3):498-503, 2008 Mar
12. Nicolau SG, Balus L. Chronic cheilitis and cancer of the lower lip. Br J Dermatol 1964;76(2): 278-89.
13. Cataldo E, Doku C. Solar cheilitis. J Dermatol Surg Oncol 1981;7(12): 989-995.
14. Koopmann Jr. CF, Coulthard SW. The oral cavity and aging. Otolaryngol Clin North Am 1982;15(2):293-312.
15. Stanley RJ, Roenigk RK. Actinic cheilitis: treatment with the carbon dioxide laser. Mayo Clin Proc 1988;63(3):230-5.
16. Huber MA, Terezhalmy GT. The patient with actinic cheilosis. Gen Dent 2006;54(4):274-82.
17. Scully C. Oral precancer: preventive and medical approaches to management. Oral Oncol 1995;31(1):16-26.
18. Brasil. Ministério da Saúde. Coordenadoria de Programas de Controle do Câncer (Pro – Onco). Câncer de boca. Rio de Janeiro: INCA; 2001.
19. Brennan JA, Boyle JO, Kock WM. Association between cigarette smoking and mutation of the p 53 gene in squamous – cell carcinoma of the head and neck. N Engl J Med 1995;332(11):712-27.
20. Winn DM. Diet and nutricion in the etiology of oral câncer. Am J Clin Nutr 1995;61(2):4375-455.
21. Lindqvist C, Teppo L, Pukkala E. Occupations with low risk of lip cancer show high risk cancer of the head. Community Dent Oral Epidemiol 1981;9:247-50.
22. Garewal HS. Response of oral leukoplakia to betacaroteno. J Clin Oncol 1993;8(10):1715-20.
23. Aguilar LT, Antunes JLF, Lehn CN, Marcucci G.Prótese, higiene, escolaridade e renda no risco do carcinoma epidermóide bucal: estudo caso-controle. Rev Assoc Paul Cir Dent. 2006;60(1): 25-8
24. Van Der Waal S. Diagnostic and therapeutic problems of oral precancerous lesions. Int J Oral Maxillofac Surg 1986;15:790-8.
25. Bánóczy J, Csiba A. Occurrence of epitelial dysplasia in oral leucoplakia: analysis and follow – up study of 12 cases. Oral Surg Oral Med Oral Pathol 1976;42(6):766-74.
26. WHO. Colaborating Centre for Oral Precancerous Lesions. Definition of leucoplakia and related lesions; an aid to studies on oral precancer. Oral Surg 1978;46(4):518-39.
27. Hosmer Jr DW, Lemeshow S. Applied logistic regression. New York: John Wiley & Sons; 1989.
28. Dardanoni L. A case-control study on lip câncer risk factors in Ragusa (Sicily). Int J Cancer 1984;34(3):335-7.
29. Kaugars GE. Actinic cheilits: a review of 152 cases. Oral Surg. Oral Med. Oral Pathol Oral Radiol Endod 1999;88(2):181-6.
Síndrome da ardência bucal
BURNING MOUTH SYNDROME
Carlos Eduardo Xavier dos Santos Ribeiro da Silva 1
Rodrigo Alarcon Cerri2
Silvia Cristina de Oliveira Bressan3
Artur Cerri 4
Francisco Octávio Teixeira Pacca5
Resumo
A Síndrome da Ardência Bucal (SAB) é uma condição caracterizada pela sensação de queimação da mucosa bucal, sem que uma causa física possa ser detectada. Afeta principalmente mulheres na pós-menopausa, com mais de 50 anos. Diversos fatores são apontados como possíveis desencadeadores dessa patologia e muito se discute sobre a importância de fatores psicogênicos, como ansiedade e depressão, na sua etiologia. Não há tratamentos estabelecidos e padronizados, sendo necessário na maioria das vezes, abordagem multidisciplinar.
Descritores:
Mucosa Bucal. Etiologia. Diagnóstico. Terapia.
1.Professor Titular da Disciplina de Estomatologia da Universidade de Santo Amaro (UNISA); Doutor pela UNIFESP
2.Especialista em Estomatologia pela Universidade de Santo Amaro (UNISA).
3.Estagiária da Disciplina de Estomatologia da Faculdade de Odontologia da UNISA.
4.Diretor da Escola de Aperfeiçoamento Profissional da APCD. Especialista, Mestre e Doutor em Estomatologia pela USP.
5. Especialista, Mestre e Doutor em Estomatologia pela USP.
Revisão de Literatura
A síndrome de Ardência Bucal (SAB) ou da “Queimação Bucal” pode ser definida como uma entidade clínica caracterizada pela dor e sensação de ardor (queimação), localizada em qualquer região da mucosa bucal, sem que se possa detectar qualquer alteração ou lesão fora dos padrões de normalidade e com achados laboratoriais normais17. A sinonímia encontrada na literatura abrange distesia oral, estomatopirose, estomatodinia7. Nos casos onde a sensação de ardência é restrita à língua são utilizados termos como glossodínia, glossopirose ou glossalgia18.
A SAB é mais prevalente em mulheres após a menopausa acima dos 50 anos de idade5,6,13,17. Sua manifestação antes dos 30 anos de idade é rara11. Os sintomas mais comuns relatados pelos pacientes são: xerostomia6,13, paladar alterado6,13, sede13, sensação de queimação na língua17 e nos lábios13. Marcucci 200511,relata que a xerostomia é a queixa bucal secundária mais frequente entre os portadores de SAB, ocorrendo em cerca de 60% dos casos. As localizações mais afetadas são ponta, borda e dorso da língua, lábios e mucosa bucal13. Terci el al18 2007, cita ainda regiões como palato e rebordo alveolar superior. Mucosa jugal, assoalho bucal e orofaringe são localizações menos frequentes11.
Segundo Nascimento et al12 2006, a bilateralidade usual da sensação dolorosa, acrescida ao fato de não respeitar a anatomia dos nervos responsáveis pela degustação, são importantes indicativos para excluir-se uma neuropatia.
Nenhuma diferença significativa em relação à idade, sexo, tempo de duração da doença ou locais de queimação foi encontrada entre os indivíduos que apresentaram a remissão parcial ou total, comparados com aqueles que continuam com o problema17.
Não é incomum paciente portador de SAB relatar dificuldade para dormir à noite e queixar-se de sono interrompido. Relatos de mudanças de humor tais como irritabilidade e diminuição no desejo de relacionamento, podem ser relacionados com padrões alterados de sono17.
A ingestão de bebidas e alimentos em temperaturas muito quentes ou muito frios, agravam os sintomas de ardência e sensação de queimação da SAB, além de alimentos condimentados e ácidos16.
Silverman et al17 2004, afirma que a remissão parcial da SAB é observada em aproximadamente dois terços dos casos dos pacientes após período de 6 a 7 anos.
Etiologia
A etiologia da SAB é desconhecida6,11,13 e dividida por diversos autores em fatores locais, sistêmicos e psicogênicos, o que evidencia o seu caráter multifatorial.
Dentre os fatores locais, podemos destacar o fumo, o álcool, o refluxo esofágico, hábitos parafuncionais (bruxismo) e próteses mal adaptadas como agentes irritantes da mucosa oral6,17. A maioria dos estudos não sustenta a irritação química ou reação alérgica aos materiais dentários como causas significativas da SAB17, porém o diagnóstico da alergia pode ser facilmente confirmado quando removido o contato do material com o tecido bucal18. Para Drage et al7 2003, o teste alérgico deve ser realizado em todos os pacientes.
As infecções bacterianas, fúngicas e virais também são apontadas como fatores locais. Dentre elas, destacam-se as infecções fúngicas causadas por Cândida albicans, maior responsável pela sensação de ardor nos portadores de próteses9.
Cavalcanti5 2003, analisou trinta e um pacientes com SAB. Nenhuma associação foi observada entre a SAB e a prevalência de leveduras do gênero Cândida. Ressaltou ainda a possível relação da síndrome com uso crônico de medicamentos, depressão, climatério e cancerofobia.
Recentes relatos de queimação bucal decorrente do uso de inibidores da enzima conversora de angiotensina (ACE), como o captropil, enalapril e lisinopril, indicaram a remissão após a descontinuação da medicação17.
A disfunção das glândulas salivares pode levar a um quadro de xerostomia, ressecando as mucosas bucais, causando desconforto e ardência15.
Bogetto et al3 1998, afirma que existem alguns fármacos que podem diminuir o fluxo salivar e com isso causar o aparecimento dos sintomas da SAB, tais como os antiespasmódicos, antidepressivos, antipsicóticos, relaxantes músculos-esqueléticos, antiparkinsonianos, antiarrítmicos, antihistamínicos, anticonvulsivantes, ansiolíticos, moderadores de apetite, diuréticos e anti-hipertensivos.
Como fatores sistêmicos, estão associados a SAB o diabetes18, Síndrome de Sjoegren17,18, anemias18, deficiências hormonais (TSH)17, radioterapia, deficiências de nutricionais de vitaminas do complexo B17,18 e de ferro17,18 e o climatério18.
Nascimento et al12 2006, afirma que pacientes diabéticos são mais susceptíveis a infecções oportunistas, podendo levar a SAB devido às infecções fúngicas. O percentual de pacientes diabéticos que relatam o sintoma de ardência bucal varia de 2% a 10%.
Blachman et al1 2001, relata uma amostra de 40 pacientes com a Síndrome da Boca Ardente (SBA) em relação aos aspectos físicos e psicológicos, encontrando-se para 95 por cento deles uma deficiência de lítio sérico. Concluiu-se, mediante análise estatística, que essa relação deva ocorrer em até 88,1 por cento dos pacientes com essa síndrome.
Deficiências nutricionais prejudicam o reparo tecidual, podendo gerar despapilação da língua e conseqüentemente provocando sensação de ardor e queimação12.
Nos fatores de origem psicogênica, estão incluídos indivíduos ansiosos, desconfiados, deprimidos, cancerofóbicas e os psicóticos maníacos depressivos.
Rodriguez et al16 2007, realizaram um estudo em 83 pacientes portadores de SAB onde 63% apresentavam transtornos psicológicos, com destaque para ansiedade, depressão e alterações durante o sono.
Diagnóstico
O diagnóstico da ardência bucal é eminentemente clínico. Frente à presença de qualquer lesão, estará descartada a hipótese de SAB. Além da anamnese detalhada, procura-se traçar um perfil psicológico do paciente. Patologias como o líquen plano, língua geográfica e a estomatite protética produzem sensações semelhantes às da SAB13,18.
Exames complementares como cultura para Cândida albicans, hemograma completo, glicemia em jejum, níveis de ferro sérico, níveis de vitamina B, dosagem hormonal, níveis de secreção salivar e os testes sorológicos para anticorpos da Síndrome de Sjoegren são amplamente utilizados13,15.
Tratamento
Apesar de não constituir uma doença grave e não representar risco à vida do indivíduo, a SAB é um transtorno que leva boa parte da população acometida à busca de um tratamento que ainda não existe6.
O uso de antidepressivos tricíclicos (TCA), alivia a queimação bucal em alguns pacientes. Os mais usados são a amitriptilina (TryptanolR), desipramina, nortriptilina, imipramina (ImipraR) e clomipramina (AnafrilR), embora apenas a amitriptilina tenha sido avaliada em experimentos clínicos17.
Benzodiazepínicos, como o clorazepam, podem ser eficazes para alterações dolorosas como a SAB17.
O controle do consumo do fumo e do álcool deve ser promovido, bem como o balanceamento da dieta alimentar, evitando-se alimentos condimentados e de alto teor ácido. Hidratação constante da mucosa oral serve de grande alívio para os sintomas de ardência.
A prescrição de vitamina B é bastante citada na literatura como um recurso utilizado na melhoria das ardências, obtendo-se excelentes resultados9.
Nos casos onde a cultura de fungos for positiva para Cândida albicans, aplicações tópicas de Nistatina e eventual troca da prótese produzem resultados clínicos satisfatórios.
Na aplicação da laserterapia, a sintomatologia da queimação é diminuída proporcionando alívio da dor e controle da inflamação ao paciente. Os efeitos terapêuticos são imediatamente relatados pelo paciente logo após a aplicação10. A aplicação deve ser feita logo após a área acometida ser limpa e seca, com auxílio de gaze e durante a irradiação deve manter-se o campo isento de umidade, a forma de aplicação de ser pontual, com dosimetria de 4-5 J/cm² durante 2 a 3 sessões semanais, com intervalos de 48 horas até a remissão dos sintomas4.
Blom et al2 1992, afirma que a acupuntura é largamente utilizada para diferentes finalidades médicas, também representando possível método de tratamento para SAB, podendo, além de agir em terminações nervosas, gerar um aumento do fluxo salivar.
O ácido alfa-lipóico é um potente antioxidante. Essa substância apresenta uma possível ação neuroprotetora e tem mostrado eficácia no tratamento da SAB11. Femiano etal8 2004 realizaram um estudo com 192 pacientes portadores de SAB e concluíram que o uso do ácido alfa-lipóico pode ser usado como um complemento junto com outros agentes psicoterápicos, necessitando ainda de novos estudos para comprovação da sua real eficácia.
Em pacientes com estado de ansiedade e depressão, a avaliação psicológica e psicoterapia são recomendadas como parte do tratamento6,11.
A capsaicina tem tido seu uso diminuído pelo incômodo de aumentar a sensação de ardor no início do tratamento, pelos efeitos colaterais gerados pelo uso sistêmico (irritação gástrica) e pela baixa efetividade no controle dos sintomas12. Petruzzi et al14 2004, após pesquisa com o uso sistêmico da capsaicina a 0,25% afirma que seu uso é efetivo em curto prazo, mas que devido a irritações gastrointestinais provocadas pelo uso em longo prazo, se faz necessário ainda estudos para comprovação da posologia e tempo de uso ideal da substância.
Diante das diversas possibilidades de tratamento, é de grande importância, que o cirurgião-dentista seja realista e não mostre ao paciente grande otimismo e nem ofereça solução fácil, pois este poderá ter que aceitar e aprender a conviver com a doença, no caso de um tratamento sem sucesso.
Conclusões
A Síndrome de Ardência Bucal é uma condição com múltiplos fatores etilógicos, sendo que as condições de origem psicogênicas (depressão, ansiedade e cancerofobia) estão entre as principais causas.
Novos estudos fazem-se necessários a fim de que se elucide a causa da SAB para proporcionar melhor qualidade de vida aos pacientes.
È importante o cirurgião-dentista fazer com que o paciente entenda a complexidade da síndrome e aceitar a conviver com sua sintomatologia.
Referências Bibliográficas:
1- Blachman IT, Salgado CM, Silva OMP. A carência do nível sérico de lítio e a síndrome da boca ardente: da observação à ação. Ver Odontol UNIFESP 2001;30(2):271-5.
2- Blom M, Dawidson I, Angmar-Manson B. The effect of acupunture on sw rates in patients with xerostomia. Oral Surg Oral Med Oral Pathol 1992;73(3):293-8.
3- Bogetto F, Maina G, Ferro G, Carbone M, Gandolfo S. Psychiatric comorbidity in patients with burning mouth syndrome. Psychosom Med 1998; 60: 378-85.
4- Brugnera Junior A, Santos AECG, Bologna ED, et al. Atlas de laserterapia aplicada à clínica odontológica. São Paulo: Santos, 2003.
5- Cavalcanti D. Síndrome de ardência bucal: perfil clínico de pacientes e prevalência de leveduras gênero do Cândida (tese de mestrado). São Paulo: Faculdade de Odontologia da USP; 2003.
6- Cherubini K, Maidana JD, Weigert KL, Figueiredo MA. Síndrome da ardência bucal: revisão de cem casos. Revista Odonto Ciência 2005;20(48):109-112.
7- Drage LA, Rogers RS. Burning mouth syndrome. Dermatol Clin 2003;21:135-45.
8- Femiano F, Gombos F, Scully C. Burning Mouth Syndrome: open trial of psychotherapy alone, medication with alpha-lipoic acid (thioctic acid), and combination therapy. Med Oral 2004;8(1):8-13.
9- Hugoson A, Thorstensson B. Vitamin B status and response to replacement therapy in patients with BMS. Acta. Odontol. Scand 1991;49 :367-75.
10- Ladardo TC, Brugnera Juior A, Takamoto M et al. A laserterapia no tratamento da Síndrome de Ardência Bucal-Relato de Caso Clínico. 20º Congresso Internacional de Odontologia de São Paulo 2002.
11- Marcucci G. Fundamentos de Odontologia – Estomatologia. Guanabara Koogan;2005.
12- Nascimento TD, Bordini CA, Speciali JG. Síndrome da ardência bucal: diagnóstico diferencial e revisão de tratamento. Migrâneas cefaléias 2006; 9(3):80-83.
13- Nery FS, Lauria RA, Sarmento VA, Oliveira MGA. Avaliação da ansiedade e depressão da terceira idade e sua relação com a Síndrome da Ardência Bucal. R Ci Med Biol 2004;3(1):20-29.
14- Petruzzi M, Lauritani D, Benedittis M, Baldoni M, Serpico R. Systemic capsaicin for burning mouth syndrome: short-term results of a pilot study. J Oral Pathol Med 2004; 33(2):111-4.
15- Rapoport PB, Cerchiari DP, Moricz RD, Sanjar FA, Moretti G, Guerra MM. Síndrome da boca ardente: etiologia. Rev Bras Otorrinolaringol 2006; 72(3):419-24.
16- Rodríguez RC, López LJ, Chimenos EK, Sabater RMM. Estúdio de uma muestra de pacientes con síndrome de boca ardiente. Av Odontoestomatol 2007; 23(3):141-151.
17- Silverman S, Eversole LR, Truelove EL. Fundamentos de Medicina Oral. Guanabara Koogan;2004.
18- Terci AO, Pacífico A, Braga FPF, Wienfeld I, Birman EG. Atualizando-se sobre a Síndrome de Ardência Bucal. Ver Odontol Univ Santo Amaro 2007;12(1):32-35.
Abstract
The Burning MouthSyndrome (BMS) is a condition characterized by burning sensation of the oral tissues withouta physical cause. This condition affects especially mild menopausal woman over 50 years old. Many Factors have been suggested as possible etiology of this condition. The importance of psycological factors such as anxiety and depression on the development of this condition. There is not an established treatments, nevertheless, a multidisciplinary approach is recomended.
Descriptors:
Mouth mucosa. Etiology. Diagnosis. Therapy.
Trauma-induced Dentigerous Cyst Involving the Anterior Maxilla
Eduardo Kazuo Sannomiya, DDS, MSc, PhD
Marcelo de Queiroz Nogueira, DDS
Marli de Carvalho Diniz, DDS
Francisco Octavio Teixeira Pacca, DDS, MSc, PhD
Gisele da Silva Dalben, DDS, MSc
ABSTRACT
The dentigerous cyst is the most common developmental odontogenic cyst of the jaws.
The purpose of this artide was to report the case of a dentigerous cyst associated with a permanent maxillary central incisor in a 5-year-old boy whe had suffered severe facial trauma at age 4. Panomaric and periapical radiographs revealed a well-defined radiolucent area with radiopaque borders surrounding the permanent maxillary left central incisor, causing displacement of the tooth buds of the permanent maxillary left lateral incisor and canine and root resorption of the deciduous maxillary left lateral incisor. Treatment was performed by aspiration and enucleation; the permanent maxillary left central incisor was part of the cyst and, thus, was also removed. (J Dent Child 2007;74:161-4)
KEYWORDS: CYST DENTIGEROUS, DENTAL TRAUMA, TOOTH, PRIMARY TOOTH
The dentigerous cyst is the most common developmental odontogenic cyst the jaws and accounts for 20% to 24% of all epirthelium-lined jaw cysts.
It is defined in the literature as a cyst surrounding the unerupted tooth’s crown and adhered to its cervical region.
This diagnosis should not be based only on radiographic evidence. Instead, it should include macroscopic and microscopic examination of the specimen, since various other lesions-such as unicystic ameloblastoma, odontogenic keratocysts, and central giant granuloma-may also occur in this position.
Dr. Sannomiya is professor in Dentomaxillofacial Radiology, Dentomaxillofacial Department of Oral and Maxillofacial Radiology, São Paulo Methodist University, São Paulo, Brazil, and professor of the Post Graduation Program in Orthodontics, São Paulo Methodist University; São Paulo, Brazil; Dr. Nogueira is an orthodontist and Dr. Diniz is a periodontist, both at the São Paulo Dental Association, (APCD); Dr. Pacca is professor or Oral Stomatology, Department of Stomatology, Santo Amaro University (UNISA), São Paulo; and Dr. Dalben is pediatric dentist in orofacial clefts and a a student in oral pathology, Department of Pediatric Dentstry and Community Dentistry, Hospital for Rehabilitation of Craniofacial Anomalies, University of São Paulo, Bauru, Brazil.
Correspond with Dr. Sannomiya at eduardosannomiya@hotmail.com
The pathogenesis of dentigerous cyst is still controversial. Some authors have suggested a developmental origin affecting mature teeth usually secondary to tooth impaction.
In this case, it would be initiated by accumulation of fluid within the reduced enamel or between the reduced epithelium and enamel. An inflammatory nature has also been suggested, which would affect immature teeth as a result of inflammation (eg, from a nonvital deciduous tooth), spreading to the region of the tooth follicle.
Most patients diagnosed with dentigerous cyst are younger than 20 years old; the percentage of 6- to 7-year-old patients with dentigerous cysts in only 9%. Associating this finding with tooth trauma would be even less frequent, according to Counts et al, who reported a case of an angressive dentigerous cyst in a 7-year-old child.
Due to the small number of cases at this age range and scarce reports of association with trauma, the purpose of this article was to report the case of a dentigerous cyst involving the permanent central incisor’s tooth bud of a 5-year-old child who had a history of trauma to the maxillary region.
CASE DESCRIPTION
A 5-year, 9 month-old boy presented at the Pediatric Dental Clinic of São Paulo Methodist University, São Paulo, Brazil, for initial screening. Before this, the mother had taken the child to a private dental practitioner. The professionals at São Paulo Methodist University attempted to contact this practittioner, yet he had moved to an unknown address.
During anamnesis, the mother reported that the child had suffered severe trauma to the face at age 4 years, with bleeding and lip wounds, followed by edema without need of suture. The mother did not mobility of any deciduous teeth after the trauma nor did she report any occurrence of alveolar fracture. One year later, they came to the pediatric dental clinic due to appearance of bucal swelling with cortical thinning, with sensitivity of the left anterior teeth (Figure1). Panoramic and periapical radiographs were then obtained, revealing significant root resorption of the primary maxillary left central and lateral incisors with lingual displacement left of the incisors and canine. There was also superior and distal displacement of the permanent maxillary left central and lateral incisors and canine. The radiolucency was diffused, with ill-defined borders. Except for one focal area in the midline, there was no evidence of sclerotic margin (Figure 2). Based on these clinical and radiographic characteristics, differential diagnosis included the hypotheses of dentigerous cyst, central giant cell granuloma or central hemangioma.
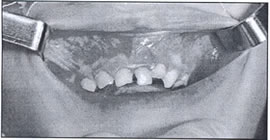
Figure 1. Intraoral aspect with mild buccal swelling.
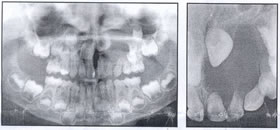
Figure 2a and 2b.
Initial panoramic and periapical radiographs demostrating well-defined radiolucent area with radiopaque borders surrounding the permanent maxillary left central incisor and displacement of tooth buds of the permanent maxillary left lateral incisor and canine.
The patient was then referred to a maxillofacial surgeon. A buccal intrasulcular incision was performed from the deciduous maxillary rigth lateral incisor to the deciduous maxillary left firt molar and two releasing incisions were made from the distal papillae of these teeth to the buccal sulcus. The attached gingiva and alveolar mucosa were thoroughly dissected to allow good surgical access.
The swollen region exhibited a very thin cortical plate, allowing aspiration of the cyst, which revealed a yellowish liquid characteristic of cystic content. Enucleation was then performed by fabrication of a window access on the bucal bone plate. The deciduous maxillary left lateral incisor was also extracted at this time.
During resection, it was noticed that the permanent maxillary left central incisor was part of the cyst. Thus, its removal was necessary (Figure 3). The surgical site was completely curetted for removal of all cystic epithelial remnants and to induce bleeding in the area for new bone formation and healing. The flap was repositioned and sutured with Vicryl 4-0.
Figure 3.
Removed cyst with tooth bud of the maxillary left central incisor-macroscopic view.
Macroscopic examination revealed that the cyst measured 2.5×2.0×1.8 cm and contained a tooth structure in its interior measuring 1.2×0.8 cm and another on its wall measuring 0.8×0.6 cm. Microscopic examination revealed tooth fragments embedded in a cystic structure lined by nonkeratinized squamous epithelium without atypical figures. The histological examination also revealed the presence of moderate inflammatory infiltrate with lymphocytes and plasma cells and capillary proliferation, which led to a final diagnosis of dentigerous cyst (Figure 4).

Figure 4
Cystic structure lined by nonkeratinized squamous epithelium without atypical figures-microscopic view, hematoxylin-eosin staining, original magnification X10.
Postsurgical follow-up was performed after 8 months. The panoramic radiograph obtained on August 2006 revealed partial repositioning of the maxillary left lateral incisor’s tooth bud. The maxillary left canine’s tooth bud is still located above the tooth buds of the maxillary left first and second premolars (Figure 5).
Figure 5
Follow-up panoramic radiograph after 8 months, demonstrating partial repositioning of the maxillary left lateral incisor and canine.
DISCUSSION
The exact histogenesis of dentigerous cysts is unknown.
Development of a dentigerous cyst, howerer, requires the presence of an unerupted tooth. Regarding its pathogenesis, Al-Talabani and Smith suggested that they may have an extrafollicular or intrafollicular origin, and that the latter may occur by fluid accumulation between the reduced enamel epithelium or within the enamel organ. It has also been suggested that the permanent tooth’s crown may erupt in a periapical cyst related to the respective deciduous tooth.
This phenomenon probably occurs, although not often, because periapical cysts are not common in the deciduous dentition. In the present case, there was a history of trauma to the deciduous maxillary central incisor. At that time, no diagnosis was made regarding impaction of the permanent maxillary central incisor. Kubota et al reported that trauma to deciduous teeth can lead to disturbances in the odontogenesis of the respective permanent teeth. Such disturbances may usually give rise to hypoplastic defects or crown/ root disruption in the permanent teeth, or even deviations from the normal eruption pathway.
This type of dentigerous cyst usually promotes bone expansion, but rarely causes cortical destruction. The growth potential of this cysts is apparently limited, but it
can cause sufficient bone expansion to promote facial asymmetry, as in the present case. Many dentigerous cysts reach great dimensions before being diagnosed. Displacement of impacted teeth to another region, such as the mandibular border, is relatively common. Movement of adjacent teeth or root resorption may also occur. In the present case, the permanent maxillary left lateral incisor’s tooth bud was severely displaced to the region of the maxillary left first and second premolars, and the tooth bud of the permanent maxillary left canine was displaced close to the maxillary sinus above the tooth bud of the permanent maxillary left lateral incisor. There was also root resorption of the deciduous maxillary left lateral incisor.
Even though the dentigerous cyst is the most frequent jaw cyst in the first decade of life, its frequency is lower in the 3 following decades. According to Shear, dentigerous cysts are primarily related to premolars and molars and rarely affect the incisors and the age range reported in the present case.
Selection of the proper surgical technique depends on the dimension of the osteolytic region and its relationship with anatomical structures observed radiographically. Enucleation is the technique of choice for small cysts. In the present case, it was possible to enucleate the entire lesion, despite the extensive bone destruction. Another surgical option would be marsupialization, usually recommended for larger cysts, which can promote decompression and lesion redduction.
In the present case, complete enucleation was preferred due to the need for differential diagnosis with odontogenic keratocyst and the interrupted root development of the central incisor. This type of cyst may be detected by routine radiographic examination. Patients with dentigerous cysts should be submitted to thorough radiographic examination combined with histopathological examination to allow selection of the proper treatment plan.
Treatment planning from now on comprises extraction of the deciduous molars at a later age to facilitate the eruption of premolars. Also, extraction of one premolar will probably be necessary for achievement of space to the maxillary left lateral incisor and canine.
REFERENCES
1. Shear M. Inflammation in dental cysts. Oral Surg 1964;17:756-67.
2. Farman GA, Nortjé CJ, Wood RE. Cysts of the jaws. In: Oral and Maxillofacial Diagnostic Imaging. 1st ed. Sr. Louis, Mo: Mosby Co; 1993:212-6.
3. Benn A, Altini M. Dentigerous cyst of inflammatory origin: A clinicopathologic study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1996;81:203-9.
4. Lustig JP, Schwartz D, Shapira A. Odontogenic cysts related to pulpotomized deciduous molars. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999;87:499-503.
5. Takagi S, Koyama S. Guided eruption of an impacted second premolar associated with a dentigerous cyst in the maxillary sinus of a 6-year-old child. J Oral Maxillofac Surg 1998;56:237-84.
6. Counts AL, Kochis LA, Buschman J, Savant TD. An aggressive dentigerous cyst in seven-year-old child. J Dent Child 2001;87:499-503.
7. Al-Talabani N, Smith CJ. Experimental dentigerous cysts and enamel hypoplasia: Their possible significance in explaining the pathogenesis of human dentigerous cysts. J Oral Pathol 1980;9:82-91.
8. Kawamura JY, Magalhães RP,Souza SC, Magalhães MH. Management of a large dentigerous cyst occurring in a 6-year-old boy. J Clin Pediatr Dent 2004;28:355-7.
9. Shibata Y, Asaumi J, Yanagi, Y, Kawai N, Hisatomi M, Matsuzaki H, Konouchi H, Nagatsuka H, et al. Radiographic examination of dentigerous cysts in the transitional dentition. Dentomaxillofac Radiol 2004;33:17-20.
10. Kubota Y, Yamashiro T, Oka S, Ninomiya T, Shirasuna K. Relation between size of odontogenic jaw cysts and the pressure of fluid within Br J Oral Maxillofac Surg 2004;42:391-5.
11. Homem MGN, Simoes WA, Zindel D, Chilvarquer I, Aparecida TA. Dentigerous cyst associated with an upper permanent central incisor: Case report and literature review. J Clin Pediatr Dent 2002;26:187-92.
12. Bodner L. Cystic lesions of the jaws in children. Int J Pediatr Otorhinolaryngol 2002;62:25-9.
13. Singh S, Singh M, Chhabra N, Nagar Y. Dentigerous cyst: A case report. J Indian Soc Pedod Prev Dent 2001;19:123-6.
14. Motamedi MH, Talesh KT. Management of extensive dentigerous cysts. Br Dent J 2005;198:203-6.
15. Jones TA, Perry Rj, Wake MJ. Marsupialization of a large unilateral mandibular dentigerous cyst in a 6-year-old boy: A case report. Dent Update 2003;30:557-61.
16. Takagi S, Koyama S. Guided eruption of an impacted second premolar associated with a dentigerous cyst in the maxillary sinus of a 6-year-old child. J Oral Maxillofac Surg 1998;56:237-9.
The Importance of Thorough Clinical and Histopathologic Evaluation in the Proper Diagnosis and Treatment of Benign and Malignant Lesions
Carlos Eduardo Xavier dos Santos Ribeiro da Silva, DDS ; Artur Cerri, DDS; Francisco Octávio Pacca, DDS; Luc Louis Maurice Weckx,DDS; Ines Velez, DDS, MS; Michael A. Siegel, DDS, MS
Learning Objectives
After reading this article, the reader should be able to:
* Describe ameloblastomas and the differences among their classifications.
* Discuss the variety of benign and malignant palatal lesions.
* Describe characteristics of how oral lesions – benign or malignant – may present upon intraoral examination.
* Explain the importance of obtaining histopathologic evaluations of lesion tissue removed from the oral cavity to render accurate diagnoses.
Abstract
Rendering a diagnosis of benign or malignant lesions in the oral environment based solely on clinical and radiographic examination is insufficient to ensure the delivery of proper treatment and the realization of the best long-term prognosis. Because many lesions exhibit characteristics similar to those of either less-aggressive or more destructive pathologies, clinicians must understand the anatomy of the tissues inherent to each area of the oral cavity, as well as the pathologies of different lesions. Additionally, when suspicious lesions are encountered, histopathologic examination should be part of the diagnostic process. This article describes several classifications of benign and malignant lesions found in the oral cavity and presents three cases to demonstrate the manner in which thorough intraoral, head/neck cancer, and histopathologic evaluations were used for diagnosis and treatment planning.
Lesson
Throughout the course of practice, clinicians may encounter patients who present with lesions in the oral cavity. Such lesions may affect the hard or soft tissues – and be either benign or malignant. Correctly diagnosing oral lesions based on clinical and radiographic examination alone may be challenging because their appearance and characteristics initially may be indicative of a different pathology.
Understanding the lesions of the jaw and the hard or soft palate requires appreciation of the different tissues inherent to each area. Knowledge of the complexity of the salivary glands and their structural components is also necessary.
During a vigilant intraoral examination, a high level of knowledge-based suspicion, as well as conducting a thorough head and neck cancer examination, are important to establishing an early and correct diagnosis of the lesion and ensuring the best prognosis for the patient. Additionally, however, microscopic histopathologic evaluation of all tissue removed from the oral cavity is paramount to determining appropriate treatment protocol, particularly when clinical and radiographic findings may suggest another pathology and, therefore, therapy for the lesion in question.
This article describes several classifications of lesions found in the oral cavity (hard/soft palate and jaws) and their respective characteristics. To emphasize the need for thorough intraoral and histopathologic evaluations to ensure the best prognosis for the patient, three cases involving benign and malignant lesions are presented. The process engaged in each case for rendering a differential and definitive diagnosis is also discussed, in addition to any recommended treatment.
Ameloblastoma
The ameloblastoma is a benign, locally aggressive, and invasive neoplasm exclusively affecting the mandible that frequently recurs after treatment.1 Guzak first described it in 1826, and Falkson provided a histological description in 1879.2
Ameloblastoma is derived from odontogenic epithelium, but there are some doubts about its histogenesis. Theories to explain the histogenesis of ameloblastomas postulate that lesions may arise from epithelial remnants of the enamel organ, proliferation of the epithelium that encases the odontogenic cysts, or the cells of the oral mucosa.3,4
According to The World Health Organization, ameloblastomas are classified as conventional, unicystic, and peripheral. Histologic subtypes are desmoplastic, follicular, granular cell, plexiform, and acanthomatous.5,6 Although locally invasive but benign, two related entities can metastasize: the histologically benign ameloblastoma that exhibits malignant behavior (ie, malignant ameloblastoma) and the ameloblastoma with malignant microscopic manifestations (ie, ameloblastic carcinoma).7
The conventional ameloblastoma demonstrates asymptomatic pathology, evolves slowly, and occurs at any age. The most frequent multicystic variant presents in patients anywhere in their 30s through their 70s; the unicystic ameloblastoma is more common in patients who are in their 20s.8
The occurrence of ameloblastoma is independent of sex or ethnic origin, and approximately 80% of cases affect the posterior mandible and ascending ramus.9 It is also commonly associated with an unerupted third molar.
Radiographically, ameloblastomas manifest as osteolytic, well-defined, multilocular lesions showing bone septa, contributing to their soap bubble or honeycomb appearance. Early lesions are unilocular. Root resorption of the involved teeth frequently occurs.10,11
Although ameloblastoma is a benign neoplasm, clinicians have sought suitable treatments because of its typically local, aggressive behavior. Extensive resections have been chosen for solid and multicystic ameloblastomas, whereas those that are unicystic have been treated with enucleation. However, there is a tendency among oral surgeons to adopt less aggressive procedures because the relapse ratios of the lesion are not very different when treated with conservative therapies (eg, enucleation and cryosurgery) compared to radical methods (eg, segmental resection with or without bone reconstruction).
Curi et al advocate that when choosing treatments for ameloblastoma, the patient’s morbidity and quality of life must be considered because extensive resections provoke such problems as chewing difficulties, mutilation, facial deformity, and abnormal mandibular movements.12 Additionally, these authors note that after observing 46 cases of solid ameloblastomas that were treated with surgical enucleation followed by cryosurgery, clinical and radiographic follow-up of the surgical complications showed that – in 30.6% of the cases – there was a local recurrence. Complications included wound dehiscence, paresthesia, infection, and pathologic fracture.12
Feinberg and Steinberg13, along with Neville14, claimed that the recurrence ratios for solid ameloblastomas were between 15% and 25% whenever more radical treatment measures were used. Nakamura et al. described a conservative therapy for cystic ameloblastomas by marsupialization and posterior enucleation that was efficient and resulted in few relapses.15 Radiotherapy, as an auxiliary therapy for ameloblastoma, was recommended in the past but then abandoned because – in addition to the risk of bone necrosis and malignant transformation caused by the radiation – the lesion is resistant to radiotherapy.16
Palatal Lesions
Torus palatinus, the most common palatal entity, presents as an osseous, exophytic, centrally located, midline, and usually symmetric asymptomatic lesion of the hard palate. The epithelial tissues covering tori are attenuated (ie, stretched) because of the underlying bony prominence, subjecting this site to ulcerations of traumatic origin. Inflammatory lesions of dental origin are also common in the hard palate.14
Malignant Squamous Epithelial Neoplasms
Malignant squamous epithelial neoplasms – such as squamous cell carcinoma, verrucous carcinoma, and carcinoma of the maxillary sinus – may also appear in the hard palate. Carcinoma of the maxillary sinus usually remains asymptomatic for long periods of time. Eventually, the tumor grows to fill the sinus and diagnosis is rendered when the lesion has produced a bulge of the palatal or alveolar ridge area. This tumor usually is associated with elderly patients.14
Squamous cell carcinoma of the soft palate is often painful, may cause dysphagia, and offers a worse prognosis than tumors located in more anterior locations. Squamous cell carcinomas extending from the maxillary alveolar ridge onto the hard palate may present a diagnostic challenge because they mimic periodontal disease or pyogenic granulomata. Alveolar and palatal carcinomas are usually painless. Verrucous carcinoma is a type of squamous cell carcinoma that exhibits a papillary, white clinical appearance; behaves indolently; and rarely metastasizes. The most common locations for this lesion are the hard palate and the alveolar ridge; it is often associated with elderly patients wearing complete denture prostheses.14
Salivary Gland Tumors
A wide range of conditions can develop in the numerous small minor salivary glands located within the submucosa of the palate. For example, necrotizing sialometaplasia is a salivary gland condition that usually appears as a crater-like defect of the posterior palate, may be associated with pregnancy, and while ominous in appearance, will usually resolve spontaneously following biopsy confirmation of the diagnosis.14
Salivary gland tumors represent a diverse group of neoplasms; the majority are of ductal or acinic epithelial derivation. Although tumors of salivary glands are not common, they are not rare in occurrence. The biologic behavior of salivary gland tumors is paradoxical. A benign tumor of salivary glands tends to exhibit a more aggressive behavior pattern than the usual benign tumor; a malignant tumor of salivary glands is less aggressive than the usual malignant tumor.17
Minor salivary gland tumors have an affinity for the posterior hard palate and the soft palate and virtually never develop in the midline; this is probably due to the natural distribution of salivary tissues throughout the palate. Both benign and malignant salivary gland neoplasms of the palate appear as well-circumscribed, dome-shaped and smooth-surfaced, nonmovable swellings that exhibit a very slow growth pattern. Pain and ulceration are occasionally seen in adenocarcinomas at this site.17
The most common benign salivary gland tumor of the palate is the pleomorphic adenoma. The most common malignant tumors of the palate are adenoid cystic carcinoma (ie, cylindroma), polymorphous low-grade adenocarcinoma, and mucoepidermoid carcinoma. Most of these tumors, both benign and malignant, are asymptomatic masses or associated with a low level of discomfort. Constant pain in the palate associated with a gradual increase in intensity that is usually present before any noticeable swelling is a common and important characteristic of adenocystic carcinoma. Malignant tumors of the palate may show radiographic evidence of bone destruction and sometimes a radiopacity produced by the neoplastic mass. Intraosseous salivary gland tumors also may develop within the jaws.17
Salivary gland tumors are considered separately from other palatal pathologies because an extensive number of these lesions have been identified. Salivary gland tumors have been classified to include 13 benign tumors and six malignant low-grade, 10 malignant intermediate-grade, and 13 malignant high-grade neoplasms.18
Melanomas
Melanoma is a malignant tumor of melanocytic origin. Although the majority occurs on the skin, they may develop in any site, such as the oral cavity, where melanocytes exist. Significant numbers of melanocytes are normally found in the palatal mucosa. In fact, the most common site for a melanocytic nevus and melanomas of the oral cavity is the palate. Approximately 30% of melanomas develop from previously existing pigmented lesions.14, 19
Oral melanoma appears predominantly on the hard palate or maxillary alveolus and tends to be much more aggressive than its cutaneous counterpart. Early lesions are usually flat and later become nodular and fixed. Most melanomas appear as dark/light brown lesions.14
The prognosis of nonskin melanoma is very poor and primarily dependant on its depth. The “3-D” rule generally can be applied to a melanoma’s prognosis. The darker the melanoma appears clinically, the deeper it is within the epithelium and, therefore, the deadlier the result. It is usually the most aggressive malignant neoplasm of the human body. To clinically differentiate a melanoma from nevus, another pneumonic that can be used is the “ABCD” system, which is widely used by dermatologists: Asymmetry of the lesion; Borders irregularity; Color variation; Diameter greater than 0.6 cm.14
Lymphoma
The posterior palate is also a part of the Waldeyer’s ring and presents numerous aggregates of normal, protective lymphoid tissue that may be the originating site of lymphoma. Lymphoma (ie, lymphosarcoma) encompasses a diverse and complex group of malignancies of lymphoid histogenesis. The most frequent locations of extranodal lymphoma in the head and neck are the posterior hard and soft palate. Lymphomas usually appear as a nontender diffuse mass and are rarely ulcerated. Many salivary gland lymphocytic infiltrates of the palate are actually non-Hodgkin’s B-cell lymphomas of the mucosal associated lymphoid tissue (MALT).14 Sarcomas, malignant tumors of nonepithelial tissue origin, may develop in any location of the human body and usually appear as ulcerated masses in young or middle-aged people.
Case Presentation No. 1: Ameloblastoma
A 25-year-old woman was referred to the Oral Surgery Department of the University of Santo Amaro – UNISA, in São Paulo, Brazil, by the Orthodontics Department for evaluation of a radiolucent lesion in the area of the missing right inferior first molar. During consultation, the patient did not report any relevant information regarding her medical history, family antecedents, dental history, or medication use.
Clinical Examination
Facial symmetry and normal skin texture were observed during the examination of her face. The head and neck examination revealed one inflamed lymph node in the right submandibular area. The remaining lymph nodes were within normal limits.
During the intraoral examination, the patient exhibited expansion of the mandible, as well as normal color of the smooth, brilliant, and well-hydrated mucous membrane. Palpation revealed crepitice of the buccal bone wall, reflecting its thin composition. Radiographically, the lesion in question presented as radiolucent, unilocular, and well-defined by a radiopaque halo. Its diameter measured approximately 2 cm, extending from the root of the mandibular right second molar to the root of the second premolar (Figure 1). The lesion also caused displacement of the right alveolar canal toward the cortical inferior border of the mandible.

No symptoms were reported, but the lesion was aspirated in order to dismiss the possibility of intraosseous hemangioma. The presence of clear, brownish liquid appeared to confirm a clinical/radiographic diagnosis of a cyst.
Since the lesion radiographically revealed the involvement of the root of the second premolar, vitality testing was performed, with negative results to heat and cold. Therefore, prior to surgery, root canal treatment was performed on this nonvital tooth.
Operative Procedure
Standard surgical preparation procedures were completed with 0.12% chlorhexidine. Using a pterygomandibular technique, the patient was anesthetized on the right side with bupivacaine. An incision was made from the distal portion of the third inferior molar to the mesial region of the canine, followed by blunt gingival retraction. Care was taken to preserve nerve integrity.
After release of the mucoperiosteal flap, the thin and expanded cortical plate was visible and removed with a scalpel. The cavity exhibited a fibrous envelope around its borders and was full of fluid.
Enucleation was carefully completed in one piece to ensure complete removal. Remaining bone tissue showed normal color and consistency, without any clinical signs of pathosis. The flap was then replaced and secured with 4-0 silk sutures.
The patient received routine postsurgical instructions and prescriptions for antibiotics and anti-inflammatory medications. The excised tissue was maintained in 10% formaldehyde and sent to the pathology laboratory for evaluation.
Histopathologic Diagnosis
The histopathologic diagnosis was acanthomatous ameloblastoma with cystic component. Because the clinical/radiographic diagnosis did not agree with the results obtained, the tissue was forwarded to another pathology laboratory, which confirmed the previous laboratory’s results (Figure 2).
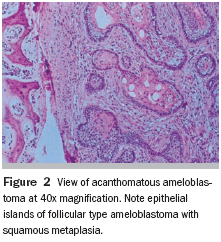
Follow-Up
Regular radiographic observation of the patient was required in order to monitor the possibility of lesion relapse, particularly because it originally presented with a well-defined capsule and was removed completely. The patient had been seen for 12 months of follow-ups, with no signs of recurrence. Bone regeneration in the affected area was visible after 12 months (Figure 3).
Case Presentation No. 2: Adenocarcinoma
A 19-year-old man presented to the Nova Southeastern University Department of Oral and Maxillofacial Surgery with a chief complaint of a “painful eruption of the wisdom tooth.” The patient was unaware of any present illness until the acute onset of the “painful eruption” approximately 2 months earlier. Medical history, dental history, social history, and family history were unremarkable. There were no extraoral signs of disease present.
Clinical Examination
Intraoral examination showed an exophytic, crater-form, ulcerated, macerated, and well-circumscribed lesion measuring approximately 2.5 cm in diameter and covered by a fibrinopurulent membrane. The lesion was located palatal to the alveolar ridge and extended to the midline of the palate (Figure 4). No radiographic manifestations were seen in panoramic, periapical, and occlusal radiographs. All teeth in the maxillary left quadrant were vital.
Diagnosis
Palatal torus and odontogenic infection were easily dismissed from the differential diagnosis by reviewing the clinical and radiographic manifestations. This lesion appeared as an ulcerated, fast-growing mass in the area where salivary gland tumors are usually located. Malignant salivary gland tumor was the first clinical consideration because of its location, aggressive nature, and rapid growth rate. Necrotizing sialometaplasia, a crater-like ulcer, does not exhibit the large nodular growth presented in this case. Therefore, it was not considered in the differential diagnosis. Conventional squamous cell carcinoma, verrucous carcinoma, and carcinoma of the maxillary sinus were dismissed because of the patient’s young age.
Sarcomas may be present in young people with the clinical characteristics seen in this case. Approximately 40% of rhabdomyosarcomas and 14% of neurogenic sarcomas occur in the head and neck area.19 They were included in the differential diagnosis.
Liposarcoma, fibrosarcoma, and chondrosarcoma are rare in the oral cavity. Osteosarcoma generally will show radiographic changes. Angiosarcoma exhibits a purple/reddish discoloration of the mucosa.14
Melanoma is commonly a dark colored lesion that usually begins as a brown to black macula with irregular borders, but then a lobulated, nonpainful mass develops later. Satellite lesions are commonly seen. However, amelanotic melanomas (ie, without melanin) occur. About 20% of oral melanomas contain so little pigment that they have a normal mucosal color.14 It is for this reason that melanoma is often included in the differential diagnosis of an aggressive lesion because it has a reputation for mimicking other pathologic entities.
MALT lymphoma was not considered in the differential diagnosis of this case. MALT lymphoma, usually a low-grade non-Hodgkin’s lymphoma, may develop into a high-grade tumor with aggressive behavior. It may appear as a diffuse palatal ulcerated mass, with borders that are not clearly delineated.14
The differential diagnosis in this case included malignant salivary gland tumor, sarcoma, and melanoma.
Operative Procedure
An outpatient incisional biopsy was performed using local anesthesia. Microscopic histopathologic examination revealed infiltrating carcinoma with a uniform pattern and duct and gland-like structures, which was not reminiscent of any other malignant neoplasm of salivary glands. Perineural invasion of the nerve sheath was present.
The diagnosis was adenocarcinoma NOS (ie, not otherwise specified). The patient was treated with a wide surgical excision and adjuvant radiation therapy. The prognosis for this tumor was poor: 56% survival at 5 years.20
Case Presentation No. 3: Working Diagnosis of Melanoma
A 38-year-old man was referred to Nova Southeastern University for the diagnosis of a mass in the left lateral palate. The patient noticed the lesion and a slight swelling of the left side of his face approximately 1 month prior to the consultation. No significant medical, dental, family, or social history was presented.
Clinical Examination
Physical examination revealed that the patient was well developed and well nourished, with a small swelling of the left maxillary aspect of his face (Figure 5). No fever, pain, bleeding, or paresthesias were identified. During the intraoral examination, a large, firm mass covered by normal mucosa that completely occupied the left palate was noted (Figure 6).
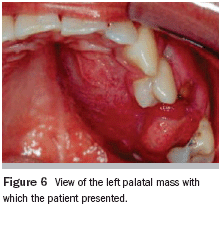
The lesion extended from the palatal midline medially into the fornix of the vestibule laterally and covered the alveolar ridge in an edentulous area. The borders of this mass were fixed to the surrounding tissues. The remaining teeth in this quadrant were vital. No radiographic changes were observed in the panoramic, occlusal, or periapical radiographs.
Diagnosis
The differential diagnosis included sarcoma, salivary gland tumor, and MALT. An outpatient incisional biopsy was performed under local anesthesia. The histopathologic examination revealed nests of atypical melanocytic cells with high mitotic activity and pleomorphic nuclei.
A working diagnosis of melanoma was rendered, and the patient was referred for positron emission tomography (PET) studies. After medical consultation, PET scanning, and medical laboratory testing, a definitive diagnosis of primary melanoma of the liver was confirmed. The patient refused treatment and returned to his country of origin.
Discussion
The diagnosis of ameloblastoma in Case No. 1 was possible only as a result of the histolopathologic evaluation that was performed. The clinical and radiographic findings initially suggested the presence of a periapical or residual cyst, when in fact the lesion was more aggressive. Likewise, periapical lesions could also visibly present as expansive and extremely large, mimicking the appearance of different, more destructive lesions. Therefore, Case No.1, in particular, reinforces the importance of histopathologic examination of all tissues removed from a patient, regardless of the initial clinical findings, to establish the correct diagnosis and determine the appropriate follow-up treatment.
Unfortunately, given the patient’s young age, the malignant salivary gland tumor component of the differential diagnosis for Case No. 2 was confirmed through histopathologic examination. Despite the poor prognosis of this tumor, the ability to precisely identify the lesion as soon as possible was paramount to initiating surgical excision and appropriate radiation therapy.
Again, diagnosis and proper treatment of palatal lesions requires a combination of astute clinical observation and histopathologic examination. In Case No. 3, the original differential diagnosis was limited to pathologies of the oral environment. However, histopathologic information suggested the need for further testing, subsequently leading to a diagnosis of primary melanoma of the liver.
Conclusion
The cases presented underscore the importance of routinely performing a thorough intraoral examination, head and neck cancer examination, and histopathologic evaluation of suspicious tissues removed from the oral cavity. Knowledgeable and conscientious clinicians should be able to readily identify lesions requiring attention and treatment. However, the specific characteristics and type of lesion – which can only be confirmed histopathologically – ultimately dictate the most appropriate therapeutic protocol to ensure the best long-term prognosis for the patient.
References
1. Kramer IRH, Pindborg JJ, Shear M. Histological typing of odontogenic tumors. International Histological Classification of Tumours. 2nd ed. Heidelberg: Springer-Verlag; 1992: 11-14.
2. Shafer WG, Hine MK, Levy BM. Tratado de patologia bucal. 4th ed. Rio de Janeiro: Interacmericana; 1985:255-263.
3. Iordanidis S, Makos C, Dimitrakopoulos J, et al. Ameloblastoma of the maxilla. Case report. Aust Dent J. 1999;44(1):51-55.
4. Kawai T, Kishino M, Hiranuma H, et al. A unique case of desmoplastic ameloblastoma of the mandible: a report of a case and brief review of the English language literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999;87(2):258-263.
5. World Health Organization (WHO); 1992.
6. Isacsson G, Andersson L, Forsslund H, et al. Diagnosis and treatment of the unicystic ameloblastoma. Int J Oral Maxillofac Surg. 1986;15(6):759-764.
7. Maia Campos G. Ameloblastoma, a behavioral and histologic paradox (a philosophical approach). Braz Dent J. 1990;1(1):5-15.
8. Kim SG, Jang HS. Ameloblastoma: a clinical, radiographic, and histopathologic analysis of 71 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001;91(6):649-653.
9. Gardner DG. Some current concepts on the pathology of ameloblastomas. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1996;82(6):660-669.
10. Regezi JA, Sciubba JJ. Oral Pathology: Clinical-Pathologic Correlations. Philadelphia: Saunders; 1989:554.
11. Reichart PA, Philipsen HP, Sonner S. Ameloblastoma: biological profile of 3677 cases. Eur J Cancer B Oral Oncol. 1995;31B(2):86-99.
12. Curi MM, Dib LL, Pinto DS. Management of solid ameloblastoma of the jaws with liquid nitrogen spray cryosurgery. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1997;84(4):339-344.
13. Feinberg SE, Steinberg B. Surgical management of ameloblastoma. Current status of the literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1996;81(4):383-388.
14. Neville, BW, Damm DD, Allen CM, et al. Oral & Maxillofacial Pathology. 2nd ed. Philadelphia: WB Saunders; 2002.
15. Nakamura N, Higuchi Y, Tashiro H, et al. Marsupialization of cystic ameloblastoma: a clinical and histopathologic study of the growth characteristics before and after marsupialization. J Oral Maxillofac Surg. 1995;53(7):748-754, discussion 755-756.
16. Santos JN, Pinto LP, de Figueredo CR, et al. Odontogenic tumors: analysis of 127 cases. Pesqui Odontol Bras. 2001;15(4):308-313.
17. Batsakis JG. Tumors of the Head and Neck: Clinical and Pathological Considerations. 2nd ed. Baltimore: Williams & Wilkins; 1979:1-99.
18. Dardick I. Color Atlas/Text of Salivary Gland Tumor Pathology. New York: Igaku-Shoin Medical Publishers; 1996:33.
19. Pilch BZ. Head and Neck Surgical Pathology. Philadelphia: Lippincott Williams & Wilkins; 2001:389-420.
20. Ellis GL, Auclair PL. Tumors of the Salivary Glands. Washington, DC: Armed Forces Institute of Pathology/Universities Associated for Research and Education in Pathology; 1996:300-73.
Unilocular ameloblastoma simulating periapical cyst:
The importance of histopathological exam.
Authors:
1. Carlos Eduardo Xavier dos Santos Ribeiro da Silva1
2. Artur Cerri
3. Francisco Octávio Teixeira Pacca
4. Luc Louis Maurice Weckx
5. Patrícia Silva
1. Professor at Santo Amaro University – UNISA ; Department of Otorhynolaringology and Head and Neck Surgery at Federal University of São Paulo – UNIFESP – Brazil
2. Professor at Santo Amaro University – UNISA
3. Professor at Santo Amaro University – UNISA
4. Chief of Department of Otorhynolaringology and Head and Neck Surgery at Federal University of São Paulo – UNIFESP – Brazil
5. Dental Surgeon
Address for Correspondence: Rua Pelotas, 358 – Vila Mariana – CEP 04012-010 – São Paulo – SP – Brazil
55 (11) 5571-1736 – dreduardosilva@terra.com.br
Keywords: Ameloblastoma – Periodontal Cyst – Odontogenics Cysts
Abstract
The ameloblastoma is a benign neoplasia, locally very aggressive tumor, arising from odontogenic epithelium of the jaws. By means of a radiographic examination, it can be classified as uni- or multi-cystic. The uni-cystic ameloblastoma is less aggressive and with a reduced potential for relapses after treatment. It prevails primarily amongst younger patients, regardless of sex or race, at the posterior area of the mandible, and it is generally associated with the third non-erupted molar. The authors report a case of a 25 years old patient, S. A, Caucasian, carrier of a radiolucent lesion in the area of tooth 46, which was absent and had not involved tooth 45. We proceeded surgical removal of the lesion suspecting a residual cyst or a periapical cyst of tooth 45. An anatomo-pathological exam revealed follicular ameloblastoma. Our purpose, with this case history, was to call the attention to the importance of a histopathological examination of all material collected from the mouth cavity, even though clinically and radiographically pathognomic signs indicate another pathology. The patient is presently under preventive surveillance, and shows signs of local bone reconstruction.
Introduction
The ameloblastoma is a benign locally aggressive neoplasia with a behavior affecting exclusively the jawbones (Kramer et al., 1992)9.
Guzak first described it, in 1826, and the first scientific publication on the subject was by Broca in 1868. In 1879, Falkson performed a histological description (Shafer et al., 1985)17.
It arises in the odontogenic epithelium. There are some doubts about the histogenesis, specially regarding the proliferation of epithelial remainders of the enamel producing organ, the proliferation of the epithelium that encases the ontogenic cysts or even the cells of the basic mucous mouth layers (Iordanidis, 1999; Kawai, 1999)5,7.
The ameloblastoma is a locally invasive neoplasia with frequent relapse after treatment that can eventually deteriorate into metastasis. (Adou, 2001)1.
According to Neville (1988)12 10% out of 30% of all odontogenic tumors are ameloblastomas.
The histological characteristics are well known to be benign in spite of the fact that quite rarely metaplasia may occur within the limits of the lesion, such as dysplasia and malignant transformation. These facts lead some authors to question its benign nature. (Maia Campos, 1990; Wilson)10.
Usually, the ameloblastoma is an asymptomatic pathology with a slow evolution, occurring at any age. The most frequent multicystic variant occurs from the thirties throughout the seventies and the unicystic ameloblastoma is more frequent in the twenties. (Kim et al, 2001)8.
The occurrence of this lesion is independent of sex or ethnic origin, affecting approximately 80% of the cases in the posterior area of the jawbone at the molars and the upper branch. (Gardner, 1984) 4.
According to WHO- World Health Organization classification in 1992, the ameloblasts are histologically classified into the following types: plexiform, follicular, granulocytes, cystic, decompensated and inflammatory (Santos et al., 2000)13,16.
The ameloblastoma is called plexiform when the epithelial cells arrange themselves in a networklike shape being limited by layers of cylindrical cells (Isacsson, G et al., 1986)6.
Radiographically, they may be described as ostelithic lesions in one site or several sites with areas of ostheogenesis forming the septa that gives the ameloblastoma the aspect of “soap bubbles” or “honeycombs”. Although it is a benign neoplasia, the root reabsorption of the involved teeth occurs frequently. (Regezi & Sciubba, 1989; Reichart et al.;1995) 14,15.
Curi et al. (1997)2 advocate that at the time to choose therapy, patient’s morbidity and quality of life must be taken into account. The reason is that extensive resections provoke problems to the patient such as chewing difficulties, mutilation, facial deformity and abnormal mandibular movements.
The same authors also observed the response in view of the surgical enucleation followed by cryosurgery in 46 cases of solid ameloblasts. The surgical complications were evaluated by clinical and X-ray follow-up, and only in 30.6% of the cases, there was a local relapse.
In 1995, Feinberg and Steinberg3 , along with Neville (1998)12, claimed that the relapse ratio for solid ameloblasts were around 15% to 25%, whenever they were treated with more radical measures.
IIt proves that less invasive approaches may be successful and are comparable to the more radical ones, enhancing the importance of a conservative therapy for amelobasts.
In spite of the fact that it is a benign neoplasia , researchers have been discussing the therapy for the ameloblastoma due to its local very aggressive behavior. Extensive resections have been chosen for the ameloblastoma in several sites, whereas the unicystical ones were treated via enucleation. However, a certain tendency seems to exist among researchers to adopt less aggressive procedures since the relapse ratios of the lesion are similar when compared with conservative therapies (enucleation and cryosurgery) and with radical ones (segmental resection with or without bone reconstruction).
Nakamura et al.,.11 in 2002, described a conservative therapy by means of marsupialization and posterior enucleation that turned out to be quite efficient and with few relapses.
Radiotherapy, as an auxiliary therapy for ameloblastoma, was recommended in the past, and then discarded because the lesion is resistant to radiotherapy, besides the risk of bone necrosis caused by X-rays and malignant transformation (Santos et al., 2000)16.
Case Report
The 25 year old, female, Caucasian patient S.A, was referred to the Mouth Surgery Department of the University of Santo Amaro – UNISA (São Paulo – Brazil ), by the Orthodontics Department to be evaluated for a radiolucent lesion, in the area of the missing first inferior pre-molar. During the anamnesis the patient did not report any relevant information regarding the medical history, family antecedents and/or orthodontics history and neither did she mention the use of any medication. Facial symmetry and normal texture of the skin and lubrication were observed, upon physical examination of the face.
When examining head and neck limphonodes only an inflammatory process of the right hand sub-mandibular area was observed. The remaining lymphonodes were normal.
Blood pressure was 120X80 mmHg and the radial pulse frequency was 88 beats per minute.
Upon the clinical examination, the patient had the loss of limits of the furrow bottom in the area, and normal color of the smooth, brilliant and well-hydrated mucous membrane. The palpation revealed clicking of the vestibular bone wall, which was quite thin. Radiographically, the lesion was a radiolucent area, circumscribed to one area, well characterized by the radiopaque halo, quite visible at the borders, with a diameter of about two centimeters, extending from the root of the second molar to the root of the second premolar including the latter. The lesion caused a dislocation of the alveolar channel toward the cortical base of the mandible.
No symptoms were reported at all. The lesion was perforated to eliminate the suspicion of hemangioma in the bone, and the presence of clear brownish liquid confirmed our clinical hypothesis of a cyst.
Since the lesion radiographically revealed the involvement of the roots of tooth 45, vitality tests were done and there was no pulpar reaction to heat, cold and impact. Thus, before surgery, root canal treatment was requested, with the filling exaggerated at the apex to facilitate the detection of the tooth tip in the process of enucleation of the lesion.

Figure 1 – Initial aspect of the lesion.
Standard procedures for intra- and extra-oral sterilization were carried out with 0.12% chlorexidine and the surgical field was sterilized. By means of a pterygomandibular technique the patient was anesthetized in the right side with bupivacaine. An incision was made from the distal portion of the third inferior molar to the mesial region of the canine, alleviating at this site. Much care was taken to preserve the nerve insertions. After release of the muco-periostal sheet it was possible to see the thin bone flange with reactive enlargement, which was removed with a scalpel. The cavity was full of liquid having a fibrous envelope around its borders. The withdrawal was carried out very carefully in a piece to insure complete removal. The remaining bone tissue showed normal color and consistency without any clinical signs of lesion. After replacement of the sheet, it was sutured with 4-0 silk threads and the patient received the routinely post surgical instructions, besides antibiotics and anti-inflammatory drugs. The removed material was maintained in 10% formaldehyde and sent to the anatomopathological laboratory.
The histopathological diagnosis is follicular ameloblastoma with cystic area. Since the clinical diagnosis was not in accordance with the obtained results, the material was forwarded to another pathology laboratory, which confirmed the first result.
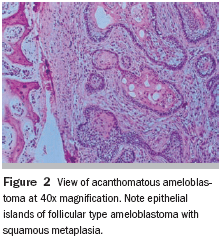
X-ray observation of the patient to control eventual relapse of the lesion was chosen since the lesion had a well-defined cystic envelope and the complete removal was possible. Presently, she is under follow-up for twelve months, without any signs of relapse and with bone restoration in the affected area.
Discussion
I Our intention in this particular case, although the X-ray findings suggesting a periapical or residual cyst, was to show that in fact it was a unicystic ameloblastoma.
Since the ameloblasts are known for their great potential of relapse, it is fundamental for the Dental Surgeon to maintain a regular and careful follow-up of this patien,t for at least three years.
The diagnosis was only possible because the anatomopathologic examination was performed in the removed material. It reinforces the requirement that every material removed from the patient must be examined, regardless of the unquestionable type of clinical diagnosis.
If the removed evidence had been discarded, we would not have had the opportunity to establish the correct diagnosis and to carry out the necessary follow-up.
Conclusions
Conclusions of the present study are as follows:
The radiolucid lesions of the jaw-bone complex shall be better understood by the C.D.;
The ameloblastoma reveals a variable prognosis and depends on a number of clinical and histological aspects;
The histopathological analysis is fundamental for an adequate treatment and prognosis;
Detailed and complete medical history in addition to complementary tests are fundamental for a better treatment of the patient.
All of the removed materials have to be examined by a pathologist
REFERENCES
1. Adou, et.al. Ameloblastoma. Odontostomatol Trop, Dakar. V.24, n.94, p.42-44,2001.
2. Curi MM, Dib LL, Pinto DS. Management of solid ameloblastoma of the jaws with liquid nitrogen spray cryosurgery. Oral Surg Oral Med Oral Pathol Oral Radiol Endond, v.84, n.4, p.339-344, 1997.
3. Feinberg SE, Steinberg B. surgical management of ameloblastoma: current status of the literature. Oral surg Oral Med Oral Pathol, v.81, p.383-388, 1996.
4. Gardner DG. Some current concepts on the pathology of ameloblastomas. Oral Surg Oral Med Oral Pathol Oral Radiol Endond, v.82, n. 6, p. 660-669 Dec 1996.
5. Iodarnidis,S. et al. Ameloblastoma of the maxilla. Case report. Aust Dent J, v.44, n.1, p.51-55,1999
6. Isacsson G. et. Al. Diagnosis and treatment of the unicystic ameloblastoma. Int. J. Oral Maxillofac Surg, v.15, p.759-764, 1986.
7. Kawai T et al. A unique case of the desmoplastic ameloblastoma of the mandibule: report of a case and brief review of the English language literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, v.,87, n.2, p.258-263,Feb. 1999.
8. Kim SG, Jang HS, Kwang-Ju. Ameloblastoma: A clinical, radiograph and histopathologic analysis of 71 cases. Oral Surg Oral Med Oral Path, St. louis, v.91.n.6,p.649-653, Jun.2001.
9. Kramer IRH, Pindborg JJ, SHEAR M. Internacional Histological Classification of Tumours. Histological Typining of Odontogenic Tumours. 2a. ed. Heidelberg: Springer – Verlag,1992. p. 11-14
10. Maia Campos G. Ameloblastoma, a Behavioral and histological Paradox (A Philosophical Aproach). Braz Dent J., Ribeirão Preto, v.1, n.1, p.5-15, 1990.
11. Nakamura, N. et al. Marsupialization of cystic ameloblastoma: a clinical and histopatologic study of the growth characteristics before and after marsupialization. J Oral Maxillofac Surg, v. 53, p.748-754,1995
12. Neville BW. et. Al. Patologia Oral e Maxilo Facial. Rio de Janeiro: Guanabara Koogan, 1998, 705p.
13. Regezzi JA, Sciuuba JJ. Oral pathology: clinical pathologic correlations. Philadelphia: Saunders; 1989.554p.
14. Reichart PA, Philipsen HP, Sonner S. Ameloblastoma: Biological Profile of 3677 cases. Oral Oncol, Eur J. Câncer, Oxford, v.31.3, n.2, p.86-99,1995.
15. Santos JN et.al. Odontogenic tumors: analysis of 127 cases. Pesqui odontol Bras, v.15, n.4, p.308-313, out/dez.2001
16. Shafer WG, Hine MK, Levy BM. Tratado de patologia bucal 4ª ed. Rio de Janeiro, Interamericana; 1985 p.255-263
17. WHO – World Health Organization, 1992.
Vias de administração de medicamentos e técnicas de injeções ao alcance do cirurgião-dentista
Drug administration lines and injection techniques in the reach of dental surgeon
Francisco Octávio Teixeira PACCA
Professor da disciplina de Semiologia / Estomatologia da Unisa – UnG – Unicastelo
Diretor da Sociedade Paulista de Estomatologia e Câncer Bucal-SOPE
Doutorando em Semiologia pela FOUSP.
Carlos Eduardo Xavier dos Santos RIBEIRO DA SILVA
Professor da disciplina de Semiologia / Estomatologia da Unisa – UnG – Unicastelo
Diretor da Sociedade Paulista de Estomatologia e Câncer Bucal-SOPE
Doutorando em Estomatologia pela UNIFESP
Artur CERRI
Professor Titular da disciplina de Semiologia/Estomatologia da Unisa _ UnG – Unicastelo
Vice-Presidente da Sociedade Paulista de Estomatologia e Câncer Bucal-SOPE
Rosiene de Freitas LIMA
Estagiária da disciplina de Semiologia/Estomatologia da Unicastelo
Especialista em Estomatologia pelo Hospital Heliópolis – SP
A prescrição e a administração de medicamentos é um ato de competência legal do Cirurgião-Dentista, que pode ser empregado em oportunidades terapêuticas e situações de Emergência. Isso requer do profissional o conhecimento técnico-científico das especialidades farmacêuticas, suas vias de administração, formas farmacêuticas e por fim suas respectivas técnicas de aplicação.
O objetivo deste trabalho é mostrar as Vias de Administração possíveis, além de detalhar algumas técnicas de injeções, utilizadas para administração de medicamentos por via parenteral, principalmente empregadas em inúmeras situações de Emergência que possam acometer o paciente.
Palavras – chave:
Uso de medicamentos – Administração de Medicamentos – Odontologia
INTRODUÇÃO E RESUMO DA LITERATURA:
Segundo a lei 5081, de 24 / 08 / 1966 que regulamenta o exercício da odontologia, compete ao Cirurgião-Dentista, ( dentre outros procedimentos ), prescrever e aplicar especialidades farmacêuticas de uso interno e externo indicadas em odontologia, e ainda prescrever e aplicar medicação de urgência no caso de acidentes graves que comprometam a vida e a saúde do paciente.
Devemos entender que a via de administração é o caminho pelo qual um medicamento é levado ao organismo para exercer o seu efeito( BASILE & PAULO,1994 ). Desta forma as vias de administração são classificadas da seguinte forma: ( CASTRO & COSTA, 1999)
Enteral (uso interno):
Oral
Sublingual
Retal
Parenteral (uso externo):
Diretas:
a.Intra-Venosa
b.Intra-Muscular
c.Subcutânea
d.Intradérmica
e.Intra-arterial
f.Intracardíaca
g.Intratecal
h.Peridural
i.Intra-articular
Indiretas:
a.Cutânea
b.Respiratória
c.Conjuntival
d.Geniturinária
e.Intracanal
ADMINISTRAÇÃO ENTERAL:
Via Oral
Como a administração oral de medicamentos é segura, mais conveniente e menos dispendiosa, a maior parte das medicações é normalmente administrada por esta via.
As medicações para administração oral são disponíveis em muitas formas: comprimidos, comprimidos de cobertura entérica, cápsulas, xaropes, elixires, óleos, líquidos, suspensões, pós e grânulos.( Enfermagem Básica, Ed Reedel, 1999 )
As medicações orais são algumas vezes prescritas em doses maiores que seus equivalentes parenterais, porque após absorção através do trato gastrointestinal, elas são imediatamente metabolizadas no fígado antes de atingir a circulação sistêmica, diminuindo assim efeitos adversos ( CASTRO & COSTA, 1999 ). A administração oral é contra-indicada em pacientes inconscientes,náuseas e vômitos, bem como naqueles incapazes de engolir.
Via Sublingual
Permite a retenção do fármaco por tempo mais prolongado. Propicia absorção rápida de pequenas doses de alguns fármacos, devido ao suprimento sanguíneo e a pouca espessura da mucosa absortiva, permitindo a absorção direta na corrente sanguínea. O dinitrato de Isossorbida (5mg) é uma medicação administrada via sublingual em casos de Crise de Angina do Peito, situação de emergência que pode acometer alguns pacientes durante uma intervenção odontológica. As formas farmacêuticas são geralmente comprimidos que devem ser dissolvidos inteiramente pela saliva, não devendo ser deglutidos.
Via Retal
É utilizada em pacientes que apresentam vômitos, estão inconscientes ou não sabem deglutir. As formas farmacêuticas empregadas são soluções, suspensões e supositórios. Suas maiores limitações de uso são incomodidade de administração, possibilidade de efeitos irritativos para a mucosa e absorção errática devido à pequena superfície absorsiva e incerta retenção no reto.
ADMINISTRAÇÃO PARENTERAL:
O termo parenteral provém do grego “para” (ao lado) e “enteros”(tubo digestivo), significando a administração de medicamentos “ao lado do tubo digestivo” ou sem utilizar o trato gastrointestinal ( CASTRO & COSTA, 1999 ). Esta via é indicada para administração de medicamentos a pacientes inconscientes, com distúrbios gastrointestinais e nos pacientes impossibilitados de engolir. É indicada ainda quando se espera uma ação mais rápida da droga, na administração de medicamentos que se tornam ineficientes em contato com o suco digestivo ( HORTA et al, 1973 ) A via parenteral consiste na administração de medicamentos através das seguintes vias:
Vias Diretas:
Injeção Subcutânea:
Uma medicação injetada nos tecidos adiposos (gordura), abaixo da pele, se move mais rapidamente para a corrente sangüínea do que por via oral. A injeção subcutânea permite uma administração medicamentosa mais lenta e gradual que a injeção intramuscular, ela também provoca um mínimo traumatismo tecidual e comporta um pequeno risco de atingir vasos sanguíneos de grande calibre e nervos. Absorvida principalmente através dos capilares, as medicações recomendadas para injeção subcutânea incluem soluções aquosas e suspensões não irritantes contidas em 0,5 a 2,0 ml de líquido.
A heparina e a insulina, por exemplo, são geralmente administradas via subcutânea. Para os casos emergências de reação anafilática, pode-se administrar adrenalina 1:1000 pm via subcutânea. Os locais mais comuns de injeção subcutânea são a face externa da porção superior do braço, face anterior da coxa, tecido frouxo do abdômen inferior, região glútea e dorso superior. A injeção é realizada através de uma agulha relativamente curta. Ela é contra-indicada em locais inflamados, edemaciados, cicatrizados ou cobertos por uma mancha, marca de nascença ou outra lesão. Elas também podem ser contra-indicadas em pacientes com alteração nos mecanismos de coagulação ( HORTA et al, 1973 ).
Áreas de injeção subcutânea (locais pontilhados):
( FIG 1 )
Modo de Aplicação:
Selecione um local de injeção apropriado;
Limpe o local da injeção com um chumaço de algodão com álcool, iniciando pelo centro do local e movendo para fora em movimento circular. Permita que a pele seque sempre antes de injetar a medicação para evitar uma sensação de picada pela introdução de álcool nos tecidos subcutâneos;
Com a sua mão não dominante, agarre a pele ao redor do ponto de injeção firmemente para elevar o tecido subcutâneo, formando uma dobra de gordura de 2,5cm;
Segurando a seringa com a sua mão dominante , insira a bainha da agulha entre os dedos anular e mínimo da sua outra mão enquanto agarra a pele ao redor do ponto de injeção. Puxe para trás a seringa com a sua mão dominante para descobrir a agulha agarrando a seringa como um lápis. Não toque a agulha;
Posicione a agulha com o bisel para cima;
Insira a agulha rapidamente em um único movimento. Libere a pele do paciente para evitar a injeção da medicação em um tecido comprimido e irritar as fibras nervosas;
Após a injeção, remova a agulha delicadamente (mas de forma rápida) na mesma angulação utilizada para a inserção;
Cubra o local com um chumaço de algodão com álcool e massageie delicadamente (a menos que você tenha injetado uma medicação que contra indique a massagem, como a heparina e a insulina) para distribuir a medicação e facilitar a absorção.
Agulhas indicadas :10 x 6 / 7 ; 20 x 6; 20 x 7.
Insira a agulha em ângulo de 45 ou 90 graus em relação a superfície epidérmica. Dependendo do comprimento da agulha e da quantidade de tecido subcutâneo no local.
(FIG 2 )
Injeção Intradérmica:
Usada principalmente com fins de diagnóstico como em testes para alergia ou tuberculina, as injeções intradérmicas indicam quantidades pequenas, geralmente 0,5ml ou menos, dentro das camadas mais externas da pele. Por haver baixa absorção sistêmica dos agentes injetada via intradérmica, este tipo de injeção é usado principalmente para produzir um efeito local. A face ventral do antebraço é o local mais comumente utilizado por ser facilmente acessível e ausentes de pêlos ( CASTRO & COSTA, 1999 ).
Modo de Aplicação:
Limpe a superfície ventral do antebraço, com algodão embebido em álcool, e espere a pele secar;
Enquanto segura o antebraço do paciente em sua mão, puxe a pele esticando com seu polegar;
Com a sua mão livre, segure a agulha em um ângulo de 15 graus em relação ao antebraço do paciente, com a bisel da agulha virado para cima;
Insira a agulha aproximadamente 0,3 abaixo da epiderme em locais a 5 cm de intervalo. Interrompa quando o bisel da agulha estiver sob a pele e injete o antígeno lentamente. Você deve encontrar alguma resistência a ao fazer isso e deve ocorrer a formação de um vergão enquanto você injeta o antígeno;
Retire a agulha na mesma angulação em que tenha sido inserida.
Injeção Intramuscular:
Injeções Intramusculares depositam a medicação profundamente no tecido muscular, o qual é bastante vascularizado podendo absorver rapidamente. Esta via de administração fornece uma ação sistêmica rápida e absorção de doses relativamente grandes (até 5ml em locais adequados). Pelo fato de possuir uma ação rápida, esta via é utilizada em quadros de Reação Anafilática, através da administração Intramuscular de Betametazona ou Dexametasona (Disprospan R ou Decadron R), como conduta emergencial ( MENDES et al, 1988 ).
As injeções intramusculares são recomendadas para os pacientes não cooperativos ou aqueles que não podem tomar a medicação via oral e para as medicações que são alteradas pelo suco digestivo. Os tecidos musculares possuem poucos nervos sensoriais, permitindo na injeção uma administração menos dolorosa de medicações irritantes. O local de uma injeção intramuscular deve ser escolhido cuidadosamente, levando em consideração o estado físico geral do paciente e a proposta da injeção. As injeções intramusculares são contra-indicadas em pacientes com mecanismo de coagulação prejudicados, em pacientes com doença vascular periférica oclusiva, edema e choque, porque estas moléstias prejudicam a absorção periférica. Além de não serem administrado em locais inflamado, edemaciado ou irritado ou ainda em locais com manchas de nascença, tecido cicatrizado ou outras lesões.
Locais de Aplicação: ( FIGS 3 e 4 )
Modo de Aplicação:
Escolha um local adequado para a injeção. Os músculos glúteos são geralmente utilizados em adultos sadios, embora o músculo deltóide possa ser utilizado para uma injeção de pequeno volume (2ml ou menos). Para neonatos e crianças, o músculo vasto lateral da coxa é mais utilizado porque é geralmente mais desenvolvido e não contem nervos grandes ou vasos sangüíneos calibrosos, minimizando o risco de uma lesão grave. O músculo reto anterior também pode ser utilizado em neonatos, mas geralmente é contra-indicado em adultos.
Limpe a pele com algodão e álcool e aguarde a pele secar;
Com os dedos polegar e indicador da sua mão não dominante, agarre suavemente a pele do local da injeção;
Posicione a seringa em um ângulo de 90 graus em relação à epiderme. Insira a agulha rápida e firmemente através das camadas dérmicas, profundamente até o músculo;
Após a injeção, remova a agulha em um ângulo de 90 graus;
Massageie o músculo relaxado para ajudar a distribuir a medicação e ajudar a promover a absorção.
Agulhas indicadas: 25 x 7/8; 30x 7/8
Injeção Intra-óssea:
Quando for difícil ou impossível à infusão venosa rápida, a infusão intra-óssea permite a disposição de líquidos, medicações ou sangue total na medula óssea. Executada em neonatos e crianças, esta técnica é utilizada em emergências como parada cardiopulmonar ou colapso circulatório, hipopotassemia, provocada por lesão traumática ou desidratação, estado epilético, estado asmático, queimaduras, pseudo-afogamento e septicemia opressiva ( KAWAMOTO & FORTES, 1997 )
Injeção Intra-articular:
Uma injeção intra-articular deposita as medicações diretamente na cavidade articular para aliviar a dor, ajudar a preservar a função, prevenir contraturas e retardar a atrofia muscular. As medicações geralmente administradas via intra-articular incluem corticosteróide, anestésicos e lubrificantes. É contra-indicada em pacientes com infecção articular, fratura ou instabilidade articular ou infecção fúngica sistêmica ( KAWAMOTO & FORTES, 1997 )
Injeção Intra-Venosa ou Endovenosa:
É a administração de uma droga diretamente na veia, a fim de obter uma ação imediata do medicamento. A medicação poderá ser administrada em qualquer veia periférica acessível, mas com preferência para:
Dobra do Cotovelo: Basílica, Mediana e Cefálica;
Antebraço;
Dorso das mãos.
A medicação poderá ser administrada ainda em veias profundas, por meio de cateteres endovenosos introduzidos por punção ou flebotomia ( HORTA et al, 1973 ).
Esta via é utilizada em casos de emergência na qual o paciente se encontra inconsciente, como por exemplo, nos casos de Crise Hipoglicêmica, onde a conduta seria a administração de Glicose 50% por via intra-venosa ( MENDES et al, 1988 ).
( FIG 5 )
Modo de aplicação:
Após o preparo da medicação, pedir ao paciente para abrir e fechar a mão diversas vezes, com o braço voltado para baixo (para melhorar a visualização das veias);
Escolher a veia, garrotear sem compressão exagerada, acima do local escolhido;
Pedir ao paciente para fechar a mão e manter o braço imóvel;
Fazer uma antissepsia ampla no sentido de baixo para cima;
Expelir todo o ar da seringa; com a mão esquerda, esticar a pele, fixar a veia e segurar o algodão embebido em álcool;
Colocar o bisel voltado para cima, segurar o canhão da agulha com o dedo indicador da mão direita, e a seringa com os demais dedos;
Introduzir a agulha e após o refluxo de sangue na seringa, pedir para o paciente abrir a mão, e com a mão esquerda retirar o garrote;
Administrar a medicação, retirar a agulha e comprimir com algodão embebido no álcool, sem massagear.
Observações importantes:
A solução deve ser cristalina, não oleosa e não conter flocos em suspensão;
Retirar todo ar da seringa, para não deixar entrar ar na circulação;
Aplicar lentamente, observando as reações do paciente;
Verificar se a agulha permanece na veia durante a aplicação;
Retirar a agulha na presença de hematoma, infiltração ou dor. A nova picada deverá ser em outro local, de preferência em outro membro.
Via Intra-arterial:
É raramente empregada, por dificuldades técnicas e riscos que oferece.
A justificativa de uso tem sido obter altas concentrações locais de fármacos, antes de ocorrer sua diluição por toda circulação. Uma variante dessa é a via intracardíaca, hoje em desuso, desde que foi substituída pela punção de grandes vasos venosos para administrar fármacos em reanimação cardio-respiratória ( CASTRO & COSTA 1999).
Vias Indiretas:
Via Cutânea:
A pele apresenta efetiva barreira à passagem de substâncias. No entanto medicamentos podem ser administrados por via cutânea para obtenção fundamentalmente de efeitos tópicos. Sob certas circunstâncias produzem efeitos sistêmicos, terapêuticos ou tóxicos. A absorção depende da área de exposição, difusão do fármaco na derme (alta lipossolubilidade), temperatura e estado de hidratação da pele. As formas farmacêuticas comumente empregadas são soluções, cremes, pomadas, óleos, loções, ungüentos, geléias e adesivos sólidos, esses destinados à absorção transcutânea para obtenção de efeitos sistêmicos. As mucosas ricamente vascularizadas permitem fácil absorção de princípios ativos. Fármacos administrados diretamente sobre a mucosa tem ação local ou, se captadas pela circulação sanguínea, sistêmica ( CASTRO & COSTA 1999).
Via Respiratória:
Estendendo-se desde a mucosa nasal até os alvéolos, pode ser usada para obtenção de efeitos locais ou sistêmicos. Os medicamentos são administrados por inalação, estando sob a forma de gás ou contidas em pequenas partículas líquidas ou sólidas, geradas por nebulização ou aerossóis. As maiores vantagens desta via consistem em administração de pequenas doses para rápida ação e minimização de efeitos adversos sistêmicos. A Crise Asmática, quadro que acomete pacientes com Sistema Respiratório comprometido, requer a administração do Bromidrato de Fenoterol, nome comercial Berotec R diluídos em Soro Fisiológico ou água, feitos através de inalação com oxigênio, como conduta emergencial ( MENDES & NOGUEIRA, 1988 )
Via Conjuntival e Geniturinária:
São usualmente empregadas para obtenção de efeitos locais. As formas farmacêuticas incluem soluções, comprimidos ou óvulos vaginais, geléias, cremes e pomadas ( WANNMACHER & FUCHS, 1998 )
Via Intracanal:
Via de uso odontológico exclusivo para obtenção de efeito local de fármacos junto ao canal radicular e zona pulpar. Apesar dos dentes estarem incluídos na cavidade oral, considera-se a via intracanal como parenteral pelo fato do fármaco estar sendo administrado em área pulpar, não mais considerada como pertencente ao trato digestivo. A cavidade pulpar recebe irrigação de vasos sanguíneos e linfáticos possuindo também terminações nervosas. Dependendo do estado da doença dentária, tamanho molecular do fármaco e extensão da preparação biomecânica, os medicamentos podem alcançar a corrente sanguínea ( CASTRO & COSTA,1999 ).
CONCLUSÕES:
O presente trabalho nos permite a concluir:
Cabe ao Cirurgião-Dentista em determinadas situações prescrever e aplicar nas mais diversas formas os fármacos necessários;
O Cirurgião-Dentista moderno e atualizado deve estar capacitado e preparado para intervenções medicamentosas em caráter de urgência ou não;
O conhecimento anatômico das áreas onde os fármacos devem ser injetados é de fundamental importância;
A odontologia carece de maiores entendimentos, divulgação e função no tocante as vias e formas de administração dos fármacos ao alcance do Cirurgião-Dentista.
ABSTRACT
The prescription and the administration of medicine is a legal act of a dental- surgeon which must be applied to terapeutical opportunities and emergency situations. The profissional must have the technical-scientific knowledge of pharmaceutical specialities, its administration vias, its pharmaceutical form and at last its application techniques.
The aim of this work is to show the possible administration vias and give details about injection techniques used to medicine administration by parenteral via, applied mainly to varied emergency situations which can happen with the patients.
KEYWORDS
Drug Administration – Drug Utilization – Dentistry
REFERÊNCIAS BIBLIOGRÁFICAS
BASILE, A.C., PAULO, L.G.P. Farmacologia Aplicada.1994 p.13-21.
CASTRO, M.S.; COSTA,T.D.Vias e métodos de administração e formas farmacêuticas. In: Farmacologia Clínica para Cirurgiões-Dentistas. 1999 p. 29-35.
Enfermagem Básica- Teoria e Prática. 1999. Editora Reedel Ltda.
HORTA,WANDA AGUIAR. TEIXEIRA,MILTON DE SOUZA. Injeções Parenterais. Ver. Esc. Enfermagem USP 7(1):46-79.marc.1973.
KAWAMOTO, E.E. FORTES, J.I. Fundamentos de Enfermagem. 1997. Editora Pedagógica e Universitária Ltda.
MENDES, ISABEL AMÉLIA COSTA. NOGUEIRA, MARIA SUELY et al. Rev.Bras. Enfermagem. 41(2):93-6.abr-jun. 1988.
WANNMACHER,L.; FUCHS,F.D. Farmacologia Clínica. Fundamentos da terapêutica racional. 1998 p.29-37. Guanabara Koogan.
